УДК: 616.155.392-036.11:575]-037-053.2
Год издания: 2012
Молекулярно-цитогенетические особенности перестроек гена MLL и оценка их прогностического значения при острых лейкозах у детей
Кустанович А.М., Вашкевич Е.П., Юцкевич Р.И.
Рубрики: 76.29.47, 76.29.49
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Молекулярно-цитогенетические особенности перестроек гена MLLи оценка их прогностического значения при острых лейкозах у детей»
Сроки выполнения НИР: 2011–2013 гг.
Научный руководитель: А.М. Кустанович
Источник финансирования: Белорусский республиканский фонд фундаментальных исследований.
При остром лимфобластном (ОЛЛ) и остром миелобластном (ОМЛ) лейкозах выделяют группу хромосомных перестроек с участием гена MLL(от mixed lineage leukemia), расположенного в локусе 11q23. Анализ перестроек гена MLLимеет существенное клиническое значение для распределения пациентов с лейкозами по группам риска с целью оптимизации проводимой терапии с учетом неблагоприятного прогноза транслокаций MLL, а также для мониторинга минимальной остаточной болезни. Поэтому определение типа перестройки гена MLL является необходимым условием успешной терапии.
Цель: анализ молекулярно-биологических особенностей перестроек MLLгена и оценка их прогностического значения при острых лейкозах у детей.
Анализ перестроек гена MLL (в первую очередь MLL-AF4, MLL-AF6, MLL-AF9, MLL-AF10, MLL-ENL, MLL-ELL) в образцах костного мозга de novo пациентов с острыми лейкозами проводился с использованием мультиплексной ПЦР и цитогенетических методов. Мутации генов NPM1, WT1, CEBPAопределяли с использованием фрагментного анализа и/или секвенирования.
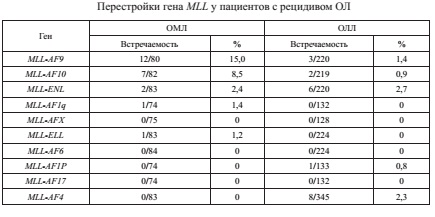
MLL-позитивные лейкозы (MLL+) определялись в 13,8% ОЛ. При ОЛЛ перестройки MLLвстречались в 8,1% случаев, при ОМЛ (не включая промиелоцитарный лейкоз (М3)) — в 28,5% (по литературным данным — 15–25% ОМЛ, включая M3) (табл. 1). При рецидивах частота встречаемости MLL+ ОЛЛ составила 12% (n=14), а MLL+ ОМЛ — 34,7% (n=23) (табл. 2).
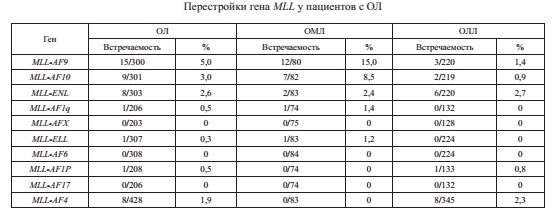
В 80% случаев MLL+ лейкозов при ОМЛ в нашем исследовании преимущественно определялась экспрессия генов MLL-AF9и MLL-AF10(что в 1,5 раза превосходит значения, приводимые другими авторами (33 и 23% соответственно); при ОЛЛ — MLL-AF4, MLL-ENL. Отмечены также единичные случаи других перестроек с участием гена MLL(MLL-AF1q, MLL-AFX, MLL-AF6).
Существует определенная линейная специфичность экспрессии химерных онкогенов с вовлечением MLL. MLL-AF4 и MLL-ENL экспрессируются преимущественно при ОЛЛ (в 6,1 и 2,3% В-линейных ОЛЛ), тогда как MLL-AF9 и MLL-AF10 встречаются в основном при ОМЛ (в 9,5 и 5,3%), хотя эта линейная специфичность не абсолютна. В то время как MLL-AF4 был обнаружен только при ОЛЛ, гены MLL-AF9, MLL-AF10 и MLL-ENLопределяются как при ОМЛ, так и при ОЛЛ. Это позволяет предположить вклад вторичных (эпи)генетических изменений или микроокружения в формирование линейности лейкоза. Существует предположение, что линейная специфичность может быть связана со сплайс-вариантами химерных транскриптов. Так, ОЛЛ чаще ассоциирован с перестройками MLL-ENL, в ходе которых MLL сливается c N-концевым участком ENL (bcr1 и bcr3), тогда как при ОМЛ чаще выявляются слияния с С-концевой областью (bcr2 и bcr4).
Распределение перестроек гена MLL в пределах различных подтипов острых лейкозов также неравномерно. При ОМЛ в 61 и 71% соответственно, экспрессия химерных генов MLL-AF9 и MLL-AF10 преимущественно определялась при M4/M5 подтипах. При ОЛЛ MLL-AF4 экспрессировался при про-В подтипе, ген MLL-ENLопределялся как при В- (на разных стадиях), так и при Т-линейном ОЛЛ (кортикальный Т-ОЛЛ).
20% детей с перестройками MLL при ОМЛ были младше 1 года, при ОЛЛ таких детей было 30%. При ОМЛ медиана возраста детей с MLL+ лейкозами составила 4,5 лет (n=19), без перестроек — 10,5 года (n=55, p<0,01), при ОЛЛ эти значения были 2,6 (n=18) и 4,9 (n=190, p>0,05). Около 80% детей с ОМЛ в возрасте до 1 года (как и до 2 лет) характеризовались перестройками MLL-гена. Среди детей старше 2 лет MLL+ лейкозы составили 20% случаев (p<0,001). При ОЛЛ у 6/9 (67%) детей до 1 года бластные клетки были MLL-позитивными, в возрасте старше года только 5,3% детей (12/223) имели в бластных клетках исследуемые перестройки MLL-гена (p<0,0001).
При MLL+ ОЛЛ был значительно выше уровень инициального лейкоцитоза, причем как для MLL-AF4, так и для MLL-ENL. При ОМЛ такого достоверного различия отмечено не было. MLL+ пациенты при ОМЛ характеризовались низкой частотой CD34+ случаев (5/18), тогда как 81% (29/36) MLL-пациентов экспрессировали этот маркер (p<0,001). Примечательно, что из 5 случаев с высоким содержанием CD34 4 (80%) были MLL-AF10-позитивные, из них 3 — с M5 подтипом ОМЛ, 1 — с M2 (p<0,01). Для ОЛЛ таких выраженных различий по экспрессии CD34 выявлено не было. Сопоставимых литературных данных по этому вопросу пока не найдено.
Анализ сочетания перестроек MLL-гена с мутациями NPM1, WT1, CEBPA, FLT3 при ОМЛ показал, что все пациенты характеризовались диким типом NPM1 (n=21), в 6% случаев определялась мутация CEBPA (которую также, как и перестройки MLL-гена, относят к мутациям II типа), в 9% — мутация WT1, FLT3-ITD была определена в 4,5% (1/22).
Анализ прогностической значимости показал, что выживаемость пациентов с перестройками гена MLL была в 2 раза ниже, чем без них (17% vs. 41% для EFS, 25% vs. 51% для RFS). Выживаемость пациентов с MLL-AF9 не отличалась от таковой у пациентов без данного химерного гена, в то время как EFS лиц с MLL-AF10была значительно ниже. Неблагоприятным прогнозом характеризовались пациенты с MLL-AF4 позитивнм ОЛЛ.
Являясь метилтрансферазой, MLL взаимодействует с другими метил- и ацетилтрансферазами как непосредственно, так и посредством других белков, участвуя в эпигенетической регуляции экспрессии генов, в особенности класса HOX. Существуют данные, что MLLможет садиться на промоторные участки ряда генов, включая HOX, препятствуя их метилированию и обеспечивая экспрессию этих генов. То есть формирование химерных генов с участием MLL может влиять на эпигенетическую регуляцию экспрессии генов, опосредуемую геном MLL. Поэтому нами был проведен анализ метилирования промоторных участков панели генов, задействованных в регуляции клеточного цикла (p15, p16, APC), апоптоза (p14, p73, DAPK1), межклеточных взаимодействий (E-кадгерин, TIMP3), детоксикации (GSTp, MGMT), репарации ДНК (MLH, MGMT, BRCA1).
Индекс метилирования составил в MLL+ острых лейкозах около 60%. При перестройках MLL-AF4 метилировано 56% генов (от 36%, 5/13 до 69% — 9/13), при MLL-ENL— метилированы промоторы 60% генов. При незлокачественных состояниях этот индекс зачастую не превышает 20–30%.
Промотор гена TIMP преимущественно деметилирован, что более характерно для MLL+ лейкозов, в первую очередь миелоидного происхождения, неметилирован ген p14, что соответствует данным Gutierrez M. et al., хотя у взрослых с ОЛЛ в 20% снижена экспрессия этого гена, как считают, вследствие метилирования.
Интересно отметить, что промоторные участки генов, участвующих в регуляции клеточного цикла — p15и p16, преимущественно метилированы, тогда как APCне метилирован вовсе. Всего 4 гена полностью неметилированы при MLL+ ОЛ, TIMP и p73 метилированы в 20–30% случаев, 3 гена полностью метилированы, остальные метилированы в 70–90% случаев.
Гетерогенность картины метилирования промоторов может указывать на то, что такое заболевание как MLL+ лейкозы может быть гетерогенным не только в плане генапартнера и клеточного микроокружения, но и в отношении более тонких различий, таких как профиль метилирования, что в свою очередь, может сказываться как на прогностическом значении MLL перестройки у конкретного пациента, так и выступать в качестве мишени для эпигенетической или направ-леннойтерапии.
Перестройки гена MLL относятся к наиболее распространенным генетическим изменениям при острых лейкозах у детей и выявляются в 10% ОЛЛ и ~30% ОМЛ (не включая M3). Перестройки гена MLL характеризуются линейной специфичностью. При ОЛЛ преимущественно определяются гены MLL-AF4 и MLL-ENL, при ОМЛ — MLL-AF9и MLL-AF10. Клинические и биологические характеристики опухолевого клона при MLL+ лейкозе зависят от типа химерного транкрипта, дополнительных (эпи)генетических изменений, клеточного контекста и различаются при ОЛЛ и ОМЛ.
Пациенты с MLL+ ОМЛ значительно моложе, чем дети без этих перестроек в опухолевом клоне и характеризуются низкой частотой экспрессии CD34+ лейкозными бластами, преимущественно ассоциированной с MLL-AF10.
MLL+ образцы характеризуются более высоким индексом метилирования — около 60% генов метилированы в каждом образце. Отдельные гены (TIMP, р14) при практически неметилированы, что может быть характеристикой MLL+ лейкозов.
Лейкозы с MLL-перестройками в целом характеризуются неблагоприятным прогнозом, хотя прогноз может определяться конкретным типом химерного гена. Анализ перестроек гена MLL имеет клиническое значение для распределения пациентов по группам риска с целью оптимизации проводимой терапии с учетом неблагоприятного прогноза транслокаций MLL.
Проведен комплексный анализ клинических и биологических характеристик лейкозных клеток c перестройкой MLL и их ассоциация с эффективностью терапии при ОЛЛ у детей.
Область применения: онкология, гематология, трансфузиология.
Рекомендации по использованию: в ходе исследования была отработана и внедрена в практику методология определения экспрессии химерных генов c вовлечении гена MLL и оценки минимальной остаточной болезни, что может в дальнейшем применятся в онкогематологической практике для мониторинга эффективности терапии и прогнозирования возникновения рецидивов.
Предложения по сотрудничеству: полученные результаты перспективны в плане дальнейшего практического применения, могут быть использованы в фундаментальных исследованиях по биологии опухолевой клетки, а также внедрены в практику учреждений образования.