УДК: 616-006.441-085.277.3:615.371/372
Год издания: 2012
Метод получения рекомбинантной идиотипической вакцины против лимфом
Мелешко А.Н., Вашкевич Е.П., Фомина Е.Г., Счесленок Е.П., Школина Т.В., Сергеев Г.В.
Рубрики: 34.15.23
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Разработать генно-инженерные и клеточные технологии для получения вакцин против лимфом in vitro»
Сроки выполнения НИР: 2010–2012 гг.
Научный руководитель: д-р мед. наук, проф., чл.-кор. НАН Беларуси О.В. Алейникова
Соисполнители: 1 — ГУ «Республиканский научно-практический центр эпидемиологии и микробиологии»; 2 — Институт биоорганической химии НАН Беларуси.
Источник финансирования: госбюджет.
Цель: разработать быстрый и максимально универсальный метод ПЦР-амплификации вариабельных доменов иммуноглобулина, сборки линейной конструкции, экспрессии и очитки рекомбинантного идиотипического белка.
Идиотип (Id) — уникальная часть молекулы иммуноглобулина, образованная вариабельными доменами тяжелой и легкой цепями иммуноглобулина, в т. ч. экспрессирующeгося на поверхности В-лимфоцитов в качестве В-клеточного рецептора. Идиотип уникален для каждого клона В-лимфоцитов. Поскольку лимфома является клональным заболеванием, идиотип может использоваться в качестве пациент-специфического опухолевого антигена.
Разработки идиотипических вакцин начались в 1992 г., когда Р. Леви и Л. Квак (Стэндфордский университет, США) впервые вакцинировали пациентов с фолликулярной лимфомой опухолевым иммуноглобулином. За последние 10 лет многочисленные клинические испытания с использованием иммуноглобулина, получен-ным с помощью гибридомной технологии как моноклональные антитела, показали иммунологический и клинический ответ у вакцинированных пациентов.
Поскольку получение индивидуальной Id-вакцины с использованием гибридом длительный и дорогостоящий метод, дальнейшие исследования были направлены на получение рекомбинантных вакцин путем клонирвоания вариабельных доменов иммуноглобулина из опухолевых клеток. Были использованы различные методы экспрессии Id-белков, включая культуры клеток насекомых, растений, бактерии E.coli или бесклеточные системы экспрессии. Обычно очищенный белок химически конъюгировали с иммуногенным белком, таким как KLH, и вводили пациенту с GM-CSF в качестве адъюванта.
Большинство методов получения рекомбинантного идиотипического белка используют клонирование вариабельных доменов обеих цепей иммуноглобулина в линейной конструкции (scFv). Серьезной проблемой этой процедуры является большое количество VH, VK и VL генных сегментов и их случайное участие в реаранжировках. Описанный способ клонирования с помощью anchored-PCR для включения 5’-концов кДНК достаточно сложный и требует дополнительного этапа синтеза кДНК и специальных реагентов. Белки, полученные в культуре клеток млекопитающих, насекомых или растений, требуют специальных условий и удлиняют время получения вакцины.
В этом исследовании, мы предлагаем способ амплификации вариабельных регионов IgM, IgG тяжелых це-пей, IgK, IgL легких цепей без добавления или потери аминокислот, а также способ сборки scFv, экспрессии и очистки рекомбинантного Id-белка из бактерий E.coli.
Методы:
1. Клеточные линии и образцы пациентов
Четыре клеточные линии лимфом, экспрессирующих иммуноглобулин IM-9, Daudi, RPMI1788 и Namalva использовались для получения идиотипа. Клетки выращивались в RPMI-1640 среде с 10% ЭТС и 2мМ глутамином. Опухолевые клетки были получены из пораженных лимфоузлов двух пациентов с лимфомой Беркитта и диффузной В-крупноклеточной лимфомой. Ткань опухоли измельчалась в 2 мл физраствора с добавлением 50 мкл RNAlater (Qiagen) к клеточной суспензии. РНК выделялась с помощью TRI reagent (Sigma). Для синтеза кДНК с MMLV-обратной транскриптазой и Oligo-dT использовался 1 мкг РНК.
2. ПЦР-амплификация вариабельных фрагментов иммуноглобулина
ПЦР была выполнена для каждого гена полугнездным способом со специально подобранной панелью праймеров. Все праймеры были оптимизированы для температуры отжига 60 °C. Реакция проводилась в 30 мкл с 12,5 пмоль каждого праймера, 200 мкМ дНТП, 1,5 мМ MgCl2 и 1U HF ДНК-полимеразы (Праймтех). Амплификация включала 20 циклов для 1 шага и 30 циклов для последующих. ПЦР-продукты проверялись в 1,5% агарозном электрофорезе.
3. Молекулярное клонирование и секвенирвоание
Фрагмент ДНК собранной scFv конструкции вырезался из агарозного геля, ДНК выделялась набором QIAquick Gel Extraction Kit (Qiagen), после чего фрагмент непосредственно лигирован в вектор pTZ57R/T через Т/А концы с использованием InsTAclone PCR Cloning Kit (Fermentas). E coli XL1-blue трансформировали кальций-хладовым методом лигазной смесью. Селекция белых и синих колоний выполнена на селективной среде S-Gal®/LB Agar Blend (SigmaAldrich) с ампициллином. Плазмидная ДНК выделялась набором EasyPrep Pro Plasmid Miniprep Kit (Perkin-Elmer). Последовательность вставки секвенировалась с плазмидными праймерами pUC19-seq-F GTTTTCCCAGTCACGACGTT и pUC19-seq-R TGTGGAATTGTGAGCGGATA. Секвенирование выполняюсь с BigDye® Terminator v.3.1 Cycle Sequencing Kit (Applied Biosystems) на аппарате ABI PRISM 3130. Плазмиды с правильной вставкой без замен были субклонированы в вектор для экспрессии pET24b (Novagen).
4. Экспрессия и очистка рекомбинантного белка
Клонированный идиотип (scFv) в векторе pET24b вводился в клетки E. coliBL21-CodonPlus (DE3)-RIPL, а трансформанты селектированы на канамицине и хлорамфениколе. Экспрессия индуцировалась с 0.5 мМ IPTG при 31 °C в течение 3 ч. Клетки собирались, ресуспензировались в буфере и разрушались ультразвуком на льду. Остатки клеток удалялись ультрацентрифугированием, супернатант собирался для электрофореза и очистки белка. Очистка выполнялась методом металл-хелатной хроматографии на колонках с Ni-NTA агарозой. Связыванием белка, промывка колонки и элюция белка выполнялась в денатурирующих условиях с 6М мочевиной. Элюция белка обеспечивалась раствором 300 мМ имидазола. Белок очищался от солей и мочевины диализом. Электрофорез белка проводился в 12% SDS-PAGE по методу Лаэмли и окрашивался Кумаси.
Дизайн праймеров для ПЦР-амплификации вариабельных доменов иммуноглобулина
Большинство В-клеточных лимфом экспрессируют имуноглобулин M или G с ?- или ?-легкой цепью. Для покрытия максимального количества лимфом мы использовали расширенную панель праймеров на 4 гена иммуноглобулинов: IgM, IgG, IgK и IgL. Последовательности всех V-генных сегментов были собраны на http://www.imgt.org. Генные сегменты были собраны по гомологии в семейства и выравнены с помощью программы AlignX из пакета Vector NTI 9.0 (Invitrogen). Прямые праймеры подбирались для первых 7–8 кодонов V-генных сегментов, избегая вариабельных или полиморфных нуклеотидов вблизи 3’-конца праймера. Такой принцип использовался для всех 6 VH семейств гена IgH, трех 3 Vk семейств гена IgK и 1–5 VL се-мейств гена IgL.
Два обратных праймера для проксимального (С1) константного региона IgM, IgG, IgK и IgL генов были подобраны для двух шагов полугнездной ПЦР-амплификации вариабельных доменов. Дистальный праймер первого шага обозначался как -3’, проксимальный как -clon. Для IgL было подобрано два альтернативных проксимальных праймера. Схематическая картина положения всех праймеров показано на рис. 1.
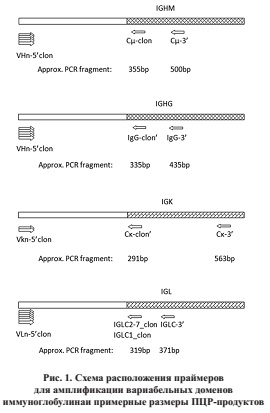
Амплификация вариабельных доменов и сборка scFv конструкции
Изотип иммуноглобулина и легкая цепь определялись методом проточной цитометрии. ПЦР для соответствующих генов были выполнены раздельно с каждой парой праймеров первого шага. Из-за сходной нуклеотидной последовательности праймеров и сегментов некоторые реакции давали небольшую неспецифическую амплификацию, которая не мешала клонированию (рис. 2а).
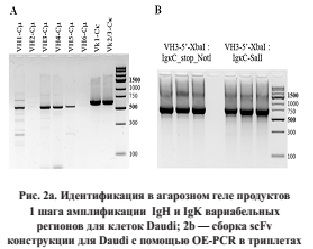
Продукты первого шага ПЦР подвергали второму этапу амплификации с прямым и проксимальным обратным праймером. Четкие полосы ПЦР-продукта ожидаемого размера вырезались из агарозного геля или очищались в полиакриламидном геле и подвергались ДНК-секвенированию для идентификации конкретных генных сегментов, участвующих в реаранжировке.
Два вариабельных фрагмента для тяжелой и легкой цепи далее объединялись вместе через 6-гистидино-вый линкер и клонировались в векторе для экспрессии. Для этого каждый из фрагментов реамплифицировался с праймерами, содержащими на 5’-конце сайты узнавания рестриктаз, старт- и стоп-кодон и 6 кодонов гистидина. Начало scFv конструкции образовывал сайт NdeI рестриктазы, содержащий старт-кодон (CATATG). Заканчивалась конструкция SalI или HindIII сайтом без добавления стоп-кодона либо сайтом NotI, которому предшествовал стоп-кодон. Первый вариант позволял включать в конструкцию дополнительный генкостимулятор как SalI/HindIII — NotI фрагмент (рис. 3).
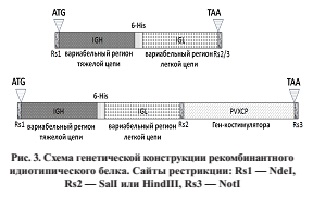
Сшивание обоих вариабельных доменов иммуноглобулина достигается методом OE-PCR. Для этого 6 кодонов гистидина CACCATCATCATCACCAC добавляется к 5’-концам V-clon праймеру IgK/IgL и обратно комплементарная последовательность 5’-концу C-clon праймера IgH. Каждый из двух фрагментов после этого очищается, смешиваются и подвергаются 10 циклам ПЦР без добавления праймеров с температурой отжига 55 °С и высокоточной полимеразой. Собранная scFv вырезается из агарозного геля (рис. 2b), элюируется ДНК и клонируется в векторе pTZ57R/T, после чего субклонируется в pET24b.
Экспрессия и очистка рекомбинантного идиотипического белка
Пять идиотипических белков для трех клеточных линий и двух пациентов с лимфомами были выделены, как описано выше. Несколько экспериментов было выполнено для отработки оптимальных условий индукции экспрессии и очистки белка. Оптимальные условия индукции — 0,4–0,5 мМ ИПТГ в течение 3 ч при 31–35 °С. Для обнаружения белка применялся электрофорез в полиакриламидном геле SDS-PAGE, позволяющий выявить полосу целевого белка в области, соответствующей 28–30 кДа.
Очистка белка выполнялась методом металлохелатной аффинной хроматографии на колонках с Ni-NTA агарозой. Меткой для аффинного связывания выступал 6-гистидиновый линкер в центре конструкции. Наши эксперименты показали, что эффективное связывание белка и промывка колонки достигалось только в денатурирующих условиях с 6М мочевиной.
Для клеточной линии Namalva были получены два варианта белка. Первый (263 аминокислоты) был клонирован как NdeI-stop-NotI фрагмент. Второй (278 аминокислот) включал дополнительный 6-His «хвост», кодируемый вектором. Оба белка были успешно очищены, что подтверждает теорию, что для очистки белка не требуется дополнительная аффинная метка (рис. 4).
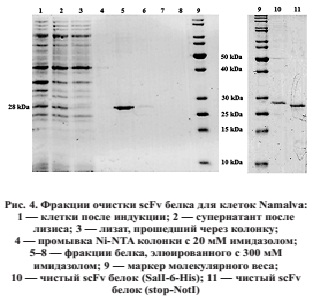
Таким образом, данное исследование направлено на получение индивидуальной генно-инженерной (рекомбинантной) идиотипической вакцины, которая будет использоваться для вакцинации тремя путями: введение белкового препарата вакцины, «нагрузка» белком in vitro аутологических дендритных клеток для последующего их введения пациенту и введение ДНК-вакцин, кодирующих идиотип и иммуногенный стимулятор. Система для экспрессии рекомбинантного белка создается на основе плазмиды E.coli, в которую возможно быстрое клонирование ДНК последовательности идиотипа из опухолевых клеток пациента. Экспрессия рекомбинантного белка идиотипической вакцины была получена в индуцибельной системе штамма E.coli BL21 и вектора для экспрессии pET24b. Экспрессия белкового продукта нужной массы свидетельствует об правильно собранной конструкции. Отработаны условия культивирования и индукции экспрессии идиотипического белка. Уровень экспрессии целевого пептида составлял не более 10% всего содержания бактериального белка, поэтому требуется высокоспецифичная система очистки. Для этого использовалась металлохелатная хроматография на колонке с Ni-NTA агарозой за счет связывания с 6-гистидиновым участком белковой молекулы, включенной в конструкцию вакцины.
Область применения: клиническая иммунология, онкология.
Предложения по сотрудничеству: начало клинических испытаний индивидуальной идиотипической вакцины на пациентах с В-клеточными лимфомами. Приглашаются учреждения здравоохранения, занимающиеся лечением неходжкинских лимфом у взрослых пациентов, а также лаборатории, специализирующиеся на очистке рекомбинантных белков.