УДК: 616-006-002.4:57.083.324]-07-053.02
Год издания: 2013
Растворимый рецептор фактора некроза опухолей первого типа в диагностике острой реакции «трансплантат против хозяина» у детей после трансплантации гемопоэтических стволовых клеток
Дорошенко Т.М., Акалович С.Т., Бакерова В.А., Автономова Е.Н., Шман Т.В., Марейко Ю.Е., Невмержицкая А.С., Минаковская Н.В., Белевцев М.В., Алейникова О.В., Войтенок Н.Н.
Рубрики: 76.29.46, 76.35.33
Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий
Тема НИР: «Разработать высокочувствительный «сэндвич» — вариант иммуноферментного анализа для определения растворимого рецептора ИЛ-8 CXCR2 человека и изучить его продукцию в комплексе с растворимым рецептором ФНО р55 и другими цитокиновыми маркерами у пациентов с гемобластозами на различных этапах терапии, включая трансплантацию гемопоэтических стволовых клеток».
Сроки выполнения НИР: 2011–2013 гг.
Научный руководитель: д-р мед. наук Н.Н. Войтенок, д-р мед. наук, проф., чл.-кор. НАН Беларуси О.В. Алейникова.
Источник финансирования: госбюджет.
Цель - оценить диагностическую значимость определения растворимого рецептора фактора некроза опухолей-α (ФНО) первого типа (рФНОР1) в плазме крови пациентов детского возраста после аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК) при развитии острой реакции «трансплантат против хозяина» (оРТПХ).
В настоящее время аллогенная ТГСК является одним из наиболее актуальных и перспективных методов лечения многих гематологических, онкологических и генетических заболеваний. Реакция РТПХ является наиболее частым и тяжелым осложнением аллогенной ТГСК и продолжает оставаться одной из главных причин смертности в посттрансплантационном периоде. На сегодняшний день в клинической трансплантологии нет серологических маркеров, позволяющих не только диагностировать, но и прогнозировать развитие у реципиентов иммунопатологических осложнений. Поэтому разработка новых подходов к ранней диагностике острой РТПХ с целью своевременной и эффективной терапии данного осложнения является актуальной. В ряде зарубежных крупномасштабных исследований предложены панели, состоящие из нескольких серологических маркеров, включая цитокины, их растворимые рецепторы, факторы роста и др.
Исследована плазма крови 21 пациента (первичный диагноз: 9 - ОЛЛ, 4 - ОМЛ, 4 - апластическая анемия, 2 - лимфома, 1 - врожденная нейтропения тяжелой степени, 1 - хроническая гранулематозная болезнь, возраст от 1,8 до 17 лет), госпитализированных в РНПЦ детской онкологии, гематологии и иммунологии. Анализировали образцы плазмы до начала режима кондиционирования (0 день, К0) и в нескольких контрольных точках после ТГСК (14, 21 или 30 день). Среди пациентов было выделено две группы: без развития оРТПХ («ТГСК без оРТПХ», n = 12) и с развитием оРТПХ 1-3 стадии («ТГСК, осложненная оРТПХ», n = 7). Группа контроля включала 24 здоровых ребенка (возраст от 8 мес. до 16 лет). Концентрацию рФНОР1 определяли с помощью «сэндвич»-ИФА, разработанного ранее в лаборатории биотехнологии антител и цитокинов РНПЦ трансфузиологии и медицинской биотехнологии. Статистический анализ результатов проводили с использованием пакета прикладных программ «Статистика 6.0» с помощью U-теста Манн-Уитни для непараметрических данных.
Хорошо известно, что в развитии и поддержании реакции «трансплантат против хозяина» участвует каскад цитокинов. Провоспалительный цитокин ФНО вовлекается на трех стадиях развития оРТПХ, начиная с повышения уровня экспрессии антигенов главного комплекса гистосовместимости и минорных антигенов клетками реципиента и заканчивая индукцией синтеза хемокинов, которые привлекают лейкоциты в ткани мишени РТПХ. Определение ФНО в образцах плазмы является низкоинформативным, в то же время показано, что рФНОР1 в отличие от самого ФНО циркулирует в крови не менее 1 сут и является стабильным маркером системных и локальных реакций, опосредованных ФНО.
Определение уровня рФНОР1 показало, что его концентрация в плазме пациентов группы «ТГСК без оРТПХ» до начала кондиционирования составила 3,8±1,4 нг/мл, что выше (р=0,002) уровня группы сравнения (2,5±0,8 нг/мл). У пациентов группы «ТГСК, осложненная оРТПХ» содержание рФНОР1 (2,9±1,6 нг/мл) достоверно не отличалось от группы сравнения.
В ходе лечения при развитии оРТПХ на 9-30 сут после ТГСК было выявлено значительное увеличение концентрации рФНОР1 в плазме в ближайшей к началу оРТПХ контрольной точке забора крови (К1) по сравнению с К0 у каждого пациента. Далее в следующей контрольной точке уровень маркера достоверно падал (р=0,0037). В группе пациентов, у которых не развилась оРТПХ, в ходе терапии ТГСК концентрация рФНОР1 существенно не изменялась. Следует отметить, что данный подход не может быть использован у пациентов с инфекционными осложнениями, у которых уровень рФНОР1 повышается в ответ на инфекцию.
Статистический анализ данных показал, что при развитии оРТПХ содержание рФНОР1 в точке К1 увеличивается более чем в 2 раза по сравнению с точкой К0 (среднее значение в группе - 2,8 раза; диапазон 1,7-4,9; р=0,0005), тогда как в группе пациентов без оРТПХ концентрация рФНОР1 в ближайшей контрольной точке изменяется в пределах 0,5-2,0 раза (среднее значение 1,2 раза; р = 0,13) (рис.).
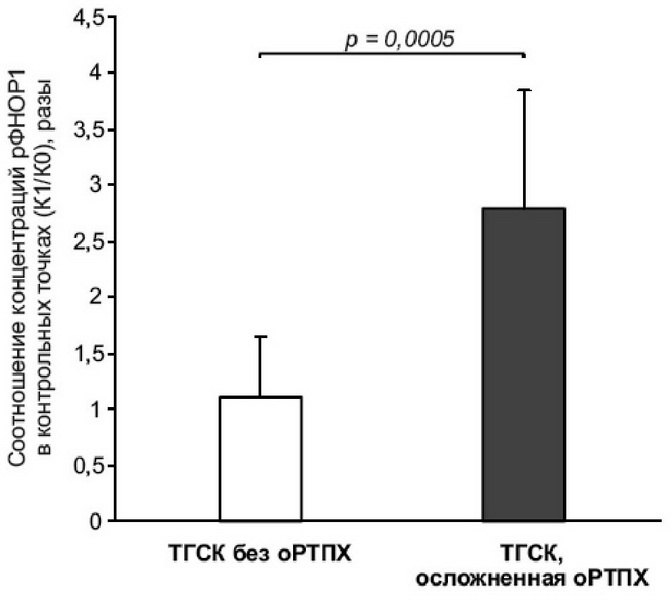
Полученные нами данные согласуются с данными S. Choi et al., которые показали, что повышение концентрации рФНОР1 в 2,5 раза и более на 7 сут терапии коррелирует с высокой частотой развития оРТПХ (Choi S., 2008), а также других авторов, включивших рФНОР1 в состав панелей серологических маркеров оРТПХ (Berger M., 2013; Paczesny N., 2009; Levine J., 2012).
Полученные данные свидетельствуют о том, что увеличение концентрации рФНОР1 более чем в 2 раза в плазме крови детей при отсутствии инфекционных осложнений указывает на развитие оРТПХ. Определение рФНОР1 можно предложить в качестве дополнительного метода диагностики оРТПХ в раннем периоде после терапии ТГСК. Доступность выполнения метода в стационаре позволяет рекомендовать его к применению в практической медицине.
Область применения: трансплантология, онкогематология.
Предложения по сотрудничеству: консультативная помощь при внедрении.