УДК: 616-007.43-089.844:576.524
Год издания: 2013
Адгезионный интерфейс для применения аутологичных клеток в герниопластике
Петренев Д.Р., Берещенко В.В., Воропаев Е.В., Лызиков А.Н.
Рубрики: 34.57.21, 76.09.31, 76.09.41, 76.29.46
Гомельский государственный медицинский университет
Тема НИР: «Разработать и внедрить клеточные технологии для оптимизации репаративных процессов поврежденного железистого эпителия и сосудистых компонентов органов».
Сроки выполнения НИР: январь 2011 г. — декабрь 2013 г.
Научный руководитель: д-р мед. наук, проф. А.Н. Лызиков.
Источник финансирования: госбюджет.
Герниопластика - наиболее часто выполняемая операция в хирургических отделениях общего профиля. Многочисленными исследованиями убедительно доказаны преимущества операций с применением дополнительных пластических материалов перед традиционными способами. В то же время использование имплантационных технологий вызывает ряд осложнений в месте протезирования. Основные причины осложнений - инфицирование протеза и нарушение процессов регенерации соединительной ткани. Первая проблема решается за счет использования сетчатых эндопротезов, изготовленных из монофиламентной полипропиленовой нити. Их структура и низкая адгезионность обеспечивает наименьшую вероятность инфицирования эндопротеза. Вторая проблема может быть преодолена путем введения аутологичных фибробластов или мезенхимальных стволовых клеток (МСК) в область регенерации. Эти клетки продуцируют большое количество ростовых факторов, что в свою очередь обеспечивает ускорение процессов ремоделинга тканей, сокращение сроков выздоровления и снижение риска развития осложнений.
Тем не менее, практическое использование клеточных технологий в герниопластике ограничено низкими адгезивными свойствами полипропиленовых протезов. Фактически закрепление клеток на поверхности полипропиленового эндопротеза наблюдается в области узлов и пересечения нитей. Таким образом, разработка способов фиксации аутологичных клеток на его поверхности является актуальной задачей.
Цель - изучить возможность фиксации живых аутологичных фибробластов на сетчатом полипропиленовом эндопротезе посредством формирования адгезионного интерфейса для клеток на его поверхности.
Для изучения процессов клеточной адгезии in vitro использовали хирургическую сетку (диаметр нити 0,12 мм, толщина сетки 0,5 мм, поверхностная плотность 62 г/м2, объемная пористость 85%). Диски из сетки o 55 мм стерилизовали в плазме H2O2. Адгезионный интерфейс из поликапролактона формировали на поверхности сетки методом испарения растворителя на стеклянной подложке в ламинарном потоке воздуха.
Динамику роста клеток in vitro на поверхности сетчатого протеза изучали с применением первичных фибробластов. Для этого в чашки Петри (ЧП) o 60 мм помещали образцы сетки, вносили 5 мл суспензии клеток (2х106кл) в полной среде (DMEM, 41966 GIBCO; L-глютамин 4 мМ; 10 мМHEPES; 1% антибиотик/антимикотик; 10% ЭТС) и инкубировали при 37°C и 5% CO2. Замену среды проводили 2-3 раза в неделю. Прижизненное микроскопирование образцов в проходящем свете производили на инвертированном микроскопе типа XDS-3FL4. На 14 сут сетки отмывали, фиксировали 2% параформальдегидом и выполняли флуоресцентные исследования.
Культуру первичных фибробластов кожи крысы (Вистар) получали стандартным методом изоляции фибробластов, мигрирующих из эксплантатов. Рутинное культивирование проводили в полной среде при 37°C и 5% CO2 в 60 мм ЧП для культивирования адгезионных культур (83.1801 SARSTEDT). В эксперимент брали клетки пятого пассажа.
На ранних этапах культивирования наблюдали практически полное отсутствие адгезии фибробластов к полипропиленовой хирургической сетке, что соответствует ранее полученным результатам для МСК. Через 24 ч после внесения клеток в ЧП в области узлов сетки и на пересечении нитей выявляли единичные клеточные элементы. Остальные клетки формировали монослой на дне ЧП. В ЧП с сеткой с покрытием клетки были сосредоточены на полимерном покрытии в виде кластеров. На 3 сут культивирования при увеличении количества клеток вышеописанный характер их распределения между поверхностью ЧП и эндопротезом сохранялся (рис. 1).
На 7 сут в ЧП с контрольными образцами наблюдали формирование 100% монослоя с характерными признаками старения клеточной популяции. Также отмечали начало восходящего прорастания монослоя через узлы сетки. Ранее сообщалось о похожем феномене в культуре МСК. В ЧП с сетками с покрытием клетки на поверхности чашек имели распластанную морфологию с большим количеством отростков при плотности монослоя от 20 до 70%. Клетки на поверхности полимерного покрытия замедлили рост и приобрели более компактную форму.
На 7 сут в ЧП с контрольными образцами наблюдали формирование 100% монослоя с характерными признаками старения клеточной популяции. Также отмечали начало восходящего прорастания монослоя через узлы сетки. Ранее сообщалось о похожем феномене в культуре МСК. В ЧП с сетками с покрытием клетки на поверхности чашек имели распластанную морфологию с большим количеством отростков при плотности монослоя от 20 до 70%. Клетки на поверхности полимерного покрытия замедлили рост и приобрели более компактную форму.
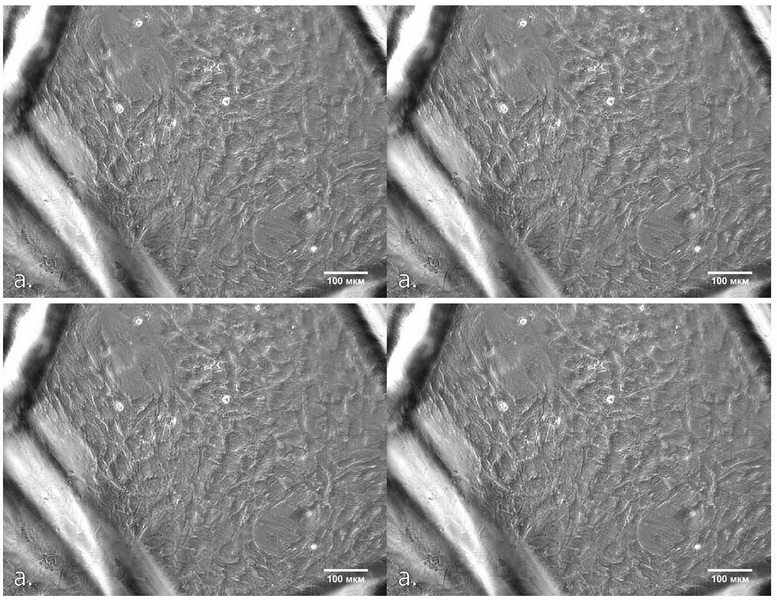
На 14 сут культивирования in vitro, на нитях необработанной сетки наблюдали формирование монослоя фибробластов, прорастающих из узловых регионов и распространяющихся вдоль волокон (рис. 2). Ранее в аналогичной экспериментальной модели с МСК подобного эффекта не наблюдали. В эти же сроки на поверхности полимерного покрытия наблюдали формирование относительно равномерного клеточного монослоя (рис. 2) без заметной деструкции полимера.
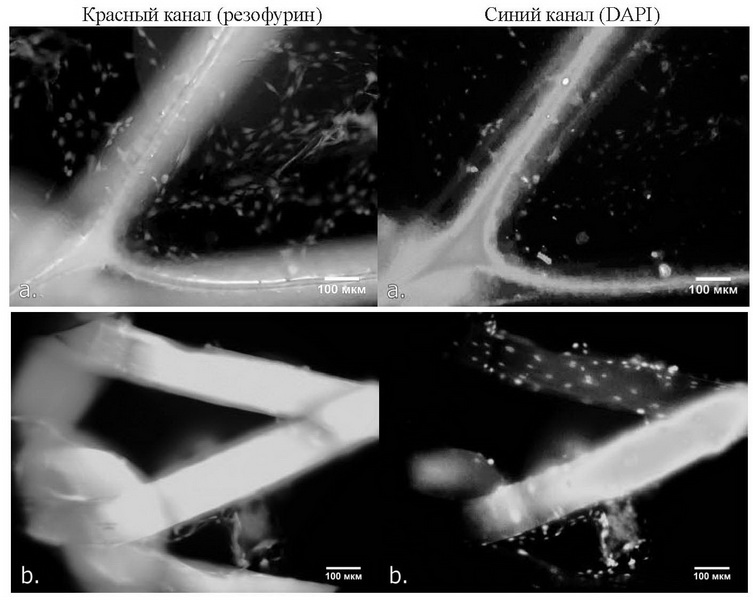
Сформированное на поверхности сетчатого полипропиленового протеза покрытие из поликапролактона увеличивает адгезионные свойства эндопротеза и обеспечивает формирование на его поверхности монослояметаболически активных фибробластов при культивировании in vitro. Данное свойство может быть использовано для закрепления аутологичных клеток на поверхности эндопротеза.
Область применения: модификация поверхности эндопротеза для герниопластики, клеточная трансплантология, регенеративная медицина.
Рекомендации по использованию: предложенный метод формирования адгезионного интерфейса на поверхности эндопротеза может быть использован для создания биосовместимого покрытия, которое улучшает показатели адгезии клеточных элементов соединительной ткани в месте имплантации, а также для предимплантационного закрепления на его поверхности аутологичных клеток in vitro. Кроме того, покрытие может быть использовано в качестве депо биологически активных соединений (антибиотики, инсулин, ростовые факторы), что обеспечит адресную доставку этих соединений и стимуляцию репарационных процессов в области оперативного вмешательства.
Предложения по сотрудничеству: консультативная помощь при внедрении, изготовление по заказам единичных изделий и малых партий продукции, совместное доведение технологии до промышленного уровня, совместные исследования в области разработки и применения клеточных технологий в трансплантологии.