УДК: 575.113:616.155.392-036.11]-053.2
Год издания: 2013
Аберрации гена IKZF1 при остром лимфобластном лейкозе у детей
Мелешко А.Н., Прохореня И.В., Доронина С.Н.
Рубрики: 34.15.23
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Изучение роли структуры и функции генов гематопоэтических транскрипционных факторов в патогенезе и прогрессировании лимфолейкозов и лимфом»» в рамках ГПНИ «Фундаментальная и прикладная медицина и фармация», подпрограмма «Фундаментальная и прикладная медицина».
Сроки выполнения НИР: 2010–2013 гг.
Научный руководитель: канд. биол. наук А.Н. Мелешко
Источник финансирования: госбюджет
Цель - определение количественного уровня экспрессии разных РНК-транскриптов гена Ikaros при ОЛЛ по сравнению со здоровым костным мозгом, а также сопоставить профиль экспрессии этого гена с наличием делеций в локусе IKZF1 при ОЛЛ.
Острый лимфобластный лейкоз (ОЛЛ) относят к наиболее распространенным онкологическим заболеваниям у детей; включает более 80% всех лимфопролиферативных заболеваний детского возраста. Хотя общая выживаемость достигает 70-75%, рецидивы заболевания остаются существенной проблемой. Классическая диагностика лейкозов как в Республике Беларусь, так и в мировой практике опирается на традиционные методы: цитоморфологическое исследование, иммунофенотипирование с помощью проточной цитометрии, цитогенетический анализ (G-banding) и ПЦР-анализ экспрессии основных химерных онкогенов. В последние годы в крупных мировых онкологических центрах наблюдается все более возрастающая ориентация на более глубокий уровень диагностических и прогностических исследований, в первую очередь выявление молекулярно-генетических изменений (мутаций) с отслеживанием минимальной остаточной болезни. Именно эти анализы позволяют наиболее приблизиться к пониманию этиологии и патогенеза заболевания, стратификации по группам риска, поиска новых мишеней для терапии и адекватной оценки эффективности терапии. Массивный прорыв исследований в этой сфере происходит в последнее десятилетие в связи с появлением технологии DNA-arrays, в первую очередь EST-array (expressed sequence tags) для анализа экспрессии, CGH- (comparative genomic hybridization) и SNP- (single nucleotide polymorphism) arrays для выявления делеций/вставок и однонуклеотидных замен, соответственно, тысяч генов одновременно. Помимо давно известных перестроек при ОЛЛ, таких как BCR/ABL, E2A/PBX, TEL/AML1 и MLL, обнаружено огромное количество несбалансированных криптических транслокаций, микроскопических делеций и точечных мутаций других генов. Однако значительный интерес представляют гены транскрипционных факторов (ТФ), специфически контролирующие лимфоидную дифференцировку, такие как pax5, EBF-1, IKZF1 (Ikaros), IKZF2 (Helios), IKZF3 (Aiolos). Структурные изменения в этих генах обнаружены у 40% пациентов с В-линейным ОЛЛ, особенно для pax5 гена (31,7%) и Ikaros (28,6%).
Ikaros, кодируемый геном IKZF1, наряду с другими генами IKZF2 (Helios), IKZF3 (Aiolos), Eos и Pegasus относятся к ДНК-связывающим белкам семейства Круппела с цинковыми пальцами. Ikaros является ключевым транскрипционным фактором, регулирующим ранние этапы дифференцировки Т- и В-лимфоцитов, NK-клеток и дендритных клеток. Гомозиготный knock-out гена IKZF1 у мышей ведет к тяжелому комбинированному иммунодефициту, тогда как гетерозиготный knock-out этого гена приводит к усиленной лимфопролиферации, высокой частоте спонтанных Т-клеточных лейкозов и лимфом, а также аутоиммунным заболеваниям. Это послужило поводом для доказанного позже предположения о роли этого гена в качестве опухолевого супрессора: нарушение его функции у человека характерно для В-лимфоидных лейкозов.
Регуляция функции гена IKZF1 (Ikaros) в норме осуществляется при участии механизма альтернативного сплайсинга. Белок Ikaros, как и другие члены семейства Ikaros, включают два отдельных домена с цинковыми пальцами: 4 ДНК-связывающих цинковых пальца N-конца и 2 цинковых пальца для белок-белковых взаимодействий около С-конца. Ген Ikaros включает семь экзонов и транскрибируется по меньшей мере в 14 различных изоформ по средствам альтернативного сплайсинга с использованием альтернативных экзонов (рис. 1). Так, Ik-1, Ikx, Ik-2, и Ik-3, которые содержат, по меньшей мере, три цинковых пальца на N-части, сохраняют высокоаффинное ДНК-связывание и локализуются в ядре. Изоформы Ik-4-Ik-10, которые имеют менее трех цинковых пальцев, теряют свою ДНК-связывающую активность и локализуются в цитоплазме. Сверхэкспрессия коротких изоформ Ikaros, в первую очередь Ik6, была описана при ОЛЛ.
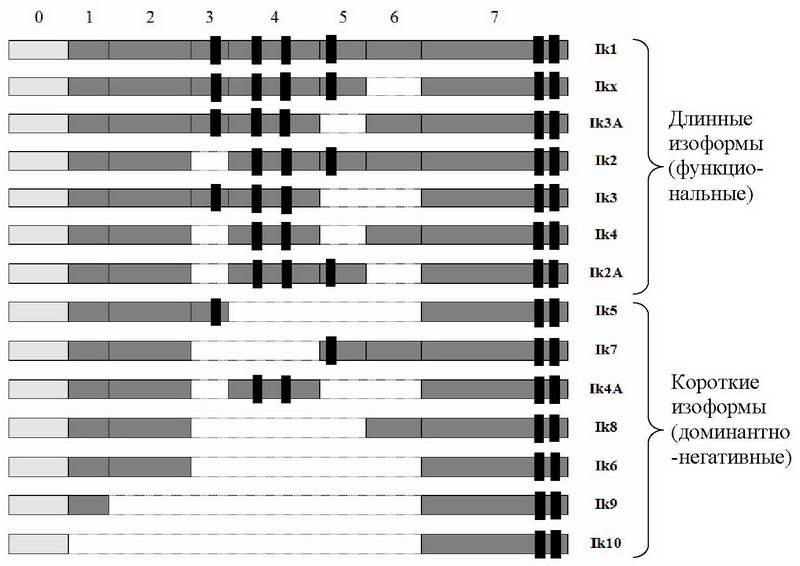
Применение метода сравнительной геномной гибридизации (CGH-arrays) в последнее десятилетие показало, что соматические внутригенные делеции в локусе IKZF1 являются очень распространенными при ОЛЛ и составляют 15-20% детских ОЛЛ, 30-50% взрослых ОЛЛ и до 75% BCR-ABL1 позитивных лейкозов. Наиболее частой является делеция кодирующих экзонов 3-6 - одна из причин сверхэкспрессии короткой изоформы Ik6. Ряд исследований доказал, что делеции в гене IKZF1 являются независимым неблагоприятным прогностическим маркером. Связь между делециями в локусе IKZF1 и изменениями в сплайсинге гена, а также прогностическое значение экспрессии разных изоформ этого гена так и остались не до конца изученными.
1. Пациенты и образцы клеток
Материалом исследования были образцы клеток костного мозга детей, больных острым лейкозом. На данном этапе размер выборки составляет 172 отдельных анализируемых образца от 130 пациентов с ОЛЛ. Среди них 116 образцов первичного ОЛЛ и 56 рецидивов. Поскольку одна из задач всего проекта - изучение участия генов ТФ в рецидивировании ОЛЛ, мы старались включить в исследование максимально возможное количество парных случаев: первичный - рецидив. В анализируемой выборке 38 парных случаев, в т. ч. 32 пары первичный ОЛЛ - рецидив и 5 пар рецидив первый - рецидив второй, 1 пара из двух рецидивов. Из 172 образцов ОЛЛ 147 имеют В-клеточный иммунофенотип, 25 - Т-клеточный.
Еще 36 образцов составляли контрольную или модельную группу. Основным адекватным контролем является костный мозг здоровых доноров. Восемнадцать образцов здорового КМ и 4 образца здоровых доноров периферической крови (ПК) составляли контрольную группу.
2. Выделение мононуклеарных клеток (МНК), выделение РНК и синтез кДНК
Образец КМ (ПК) наслаивали на 0,5 объема Histopaque 1077 (Sigma, США) и центрифугировали при комнатной температуре в течение 25 мин при 1000 g. Интерфазный слой, содержащий МНК, переносили в чистую пробирку и дважды отмывали в ФСБ (400 g, 10 мин, при +40°С) и подсчитывали микроскопически в камере Горяева. Выделение суммарной РНК проводили с использованием набора Tri-Reagent в соответствии с инструкциями производителя. Обратной транскрипцией кДНК было получено из РНК с использованием Oligo-dT18 (Праймтех, РБ) MMLV транскриптазы (Promega, США) либо Superscript® IIIRT (Invitrogen, США).
3. Количественный анализ экспрессии методом ПЦР «в реальном времени» и ПЦР-анализ делеций в гене IKZF1
Мы использовали вариант RQ-PCR с парой праймеров и TaqMan-зондом, меченным флуоресцентной меткой FAM, JOE, или ROX на 3’-конце и гасителем 5’BHQ. Последовательность праймеров и зондов были подобраны нами для изолированного измерения каждой изоформы. Реакция проводилась в 20 мкл с 50% 2х TaqMan Universal PCR MasterMix (Applied Biosystems, USA), 500 нг ДНК, 500 нг каждого праймера и 150 нг ТМ-зонда. Анализ проводился на приборе Rotor-Gene 6000 (CorbettResearch, Австралия). Делеции ΔEx3-6 и ΔEx1-6 определялись с помощью традиционной ПЦР с праймерами, подобранными к соответствующим интронам на удалении в 300-400 нуклеотидов от предполагаемой точки разрыва.
Профиль экспрессии транскриптов гена Ikaros в нормальном костном мозге и при ОЛЛ
Прежде всего, мы оценили уровень экспрессии изоформ гена Ikaros в образцах нормального костного мозга здоровых доноров. Следует отметить, что транскрипты Ikaros сами по себе не являются патогенетическими и встречаются в нормальных гемопоэтических клетках. Патогенетическое значение сверхэкспрессии или низкой экспрессии отдельных изоформ является лишь гипотезой. Изменение в уровне экспрессии может быть вызвано физиологическими причинами или различаться в клетках разной линии либо стадии дифференцировки. Фракция мононуклеарных клеток нормального костного мозга включает в себя различные типы клеток. Выявить патогенетическое значение аберрантной экспрессии какого-либо гена можно, лишь сравнивая здоровую группу с разными группами лейкозов. Сравнение профиля экспрессии Ikaros в норме и патологии представлено на рис. 2.
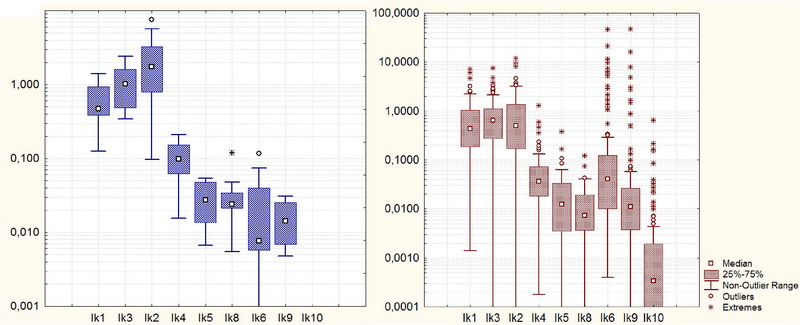
Единицей измерения экспрессии служат относительные единицы, указывающие уровень определяемой мишени относительно контрольного гена ABL (ген «домашнего хозяйства»). Таким образом, экспрессию разных мишеней можно сравнивать между собой. Для гена Ikaros в здоровом КМ явно преобладает экспрессия длинных, функциональных изоформ Ik1, Ik3, Ik2. Наиболее сильная экспрессия характерна для Ik2, что было показано нами на прежних этапах работы более грубым методом анализа в полиакриламидном геле. Выраженность этой изоформы в 2-4 раза превышает уровень контрольного гена.
Короткие, нефункциональные изоформы гена Ikaros - Ik4, Ik5, Ik6, Ik8 и Ik9 в здоровом костном мозге экспрессируются на значительно более низком уровне - от 0,1-0,01 от контрольного гена и ниже. Самая короткая изоформа, Ik10, практически не экспрессируется вообще. Несмотря на схожесть общего профиля между
донорами и пациентами с ОЛЛ у последних в части случаев наблюдается сверхэкспрессия отдельных изоформ, в первую очередь коротких Ik6, Ik9, Ik10.
4. Сравнение экспрессии длинных изоформ Ikaros при ОЛЛ и в здоровом КМ
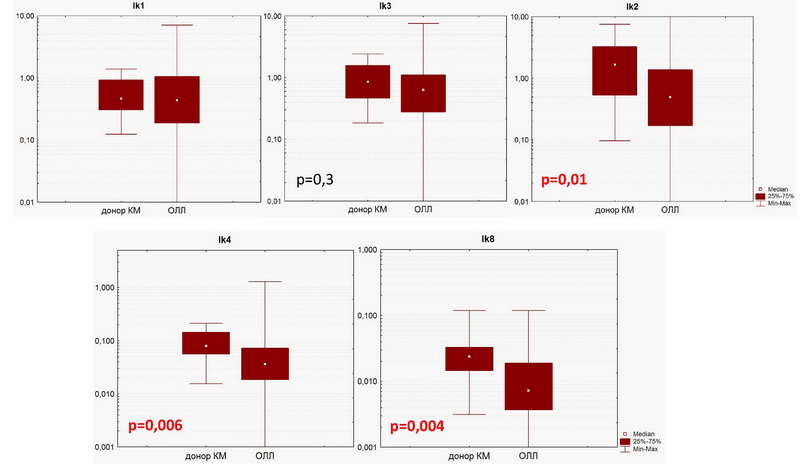
Сравнение экспрессии изоформ Ikaros пациентов с ОЛЛ с донорами КМ выполнялось методом непараметрической статистики (Mann-Whitney U Test) (рис. 3). В лейкозных клетках уровень экспрессии длинных изоформ был немного снижен, достоверно для Ik2 (p = 0,01). Это длинные, функциональные изоформы, содержащие функциональный ДНК-связывающий домен.
Интересно, но экспрессия коротких изоформ Ik4 (p = 0,006) и особенно Ik8 (p = 0,004) также снижена в опухолевых клетках по сравнению с контролем. Эта зависимость на первый взгляд противоречит исходной гипотезе об участии коротких изоформ в патогенезе ОЛЛ. Ik4 сохраняет экзон 4, содержащий два цинковых пальца. Ik8 не содержит ДНК связывающего домена вовсе и является определенно доминантно-негативной изоформой. Те же закономерности характерны и для групп В- и Т-линейного ОЛЛ.
5. Аберрантная экспрессия Ik6 и Ik9 при ОЛЛ
Среди всех изоформ гена Ikaros наибольшие отклонения при ОЛЛ выявлены для самых коротких изоформ - Ik6 и Ik9. Эти отклонения не затрагивают всю группу пациентов с ОЛЛ. Большинство лейкозов имеет примерно нормальный профиль экспрессии изоформ гена Ikaros с небольшими вариациями, обычно в сторону снижения всех изоформ (репрессии транскрипции гена Ikaros). Но в отдельных случаях ОЛЛ наблюдается сверхэкспрессия на уровне, превышающем норму на 2-3 порядка.
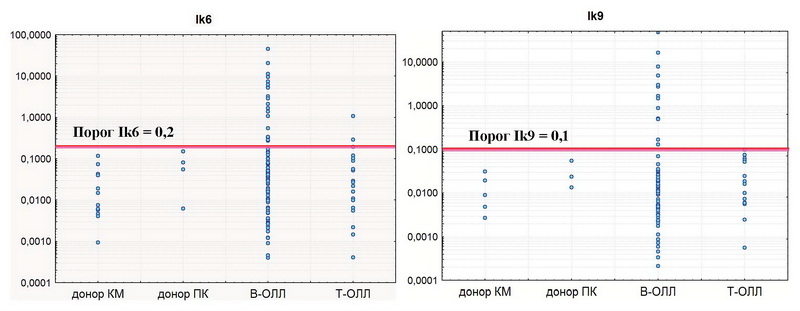
Причина этого явления пока не ясна, но существенно, что это не статистическое количественное увеличение, а качественный признак. Поскольку анализ RQ-PCR все-таки является количественным, требуется установление критерия, отличающего сверхэкспрессию Ik6 от нормы. Для этого была построена точечная гистограмма распределения экспрессии Ik6 и Ik9 (рис. 4).
Медиана уровня Ik6 в лейкозных клетках составила 0,041. Максимальное значение экспрессии Ik6 в костном мозге здоровых доноров - 0,151, медиана - 0,015. Таким образом, разделение по медиане, как это часто применяется для качественной оценки экспрессии генов, не подходит, так как планка будет занижена. Реалистичный порог сверхэкспрессии Ik6 превышает верхний возможный уровень в здоровом КМ. Исходя из распределения случаев в логарифмической шкале (рис. 4), было решено выбрать пороговым значение 0,2. С учетом этого критерия 24 из 116 образцов (20,7%) имели сверхэкспрессию Ik6.
В нормальных лимфоцитах костного мозга Ik9 экспрессируется на уровне 0,007-0,025 (медиана 0,014). В лейкозных бластах Ik9 экспрессируется с большим разбросом значений, также как и Ik6, однако диапазон уровней и медиана Ik9 несколько ниже, чем для Ik6. Исходя из различий между контрольными группами и распределением уровня Ik9 в логарифмической шкале в общей группе пациентов с ОЛЛ (рис. 4), было решено выбрать в качестве порогового критерия значение 0,1. С учетом этого критерия 13 из 116 образцов (11,2%) ОЛЛ имели сверхэкспрессию Ik9. Все 13 случаев сверхэкспрессии Ik9 имели В-линейный фенотип ОЛЛ (13/85, 15,3%) и во всех этих случаях сверхэкспрессия Ik9 совпадала со сверхэкспрессией Ik6. Можно заключить, что появление этих двух коротких изоформ при ОЛЛ определяется одним и тем же фактором.
В отличие от Ik6 и Ik9, которые имеют низкий физиологический уровень экспрессии, самая короткая изоформа, Ik10, в норме практически не выявлялась. В одном случае нормального КМ зафиксирован уровень Ik10=0,0036. В связи с этим определение порогового уровня для сверхэкспрессии этой изоформы затруднено. В такой ситуации лейкоз оценивается как Ik10-позитивный в случае любой воспроизводимой амплификации с характерной логистической формой кривой ранее 40 цикла с ?Ct в репликах (дуплете или триплете) ?2. Опираясь на такой технический критерий, мы признали Ik10-позитивными четыре случая ОЛЛ с уровнем значения Ik10 выше 0,1. Такой уровень, аналогичный Ik9, был выбран в качестве рабочего критерия для оценки статуса экспрессии Ik10 у пациентов с ОЛЛ.
6. Внутригенные делеции в локусе IKZF1
Согласно последним данным при ОЛЛ в гене IKZF1 (Ikaros) с относительно высокой частотой встречаются внутригенные делеции, ассоциированные с плохим прогнозом. Генетические поломки этого локуса при лейкозах разнообразные, но в большинстве случаев ОЛЛ сводятся к всего к двум доминирующим типам делеций - делеции, включающие 3-6 кодирующий экзон (4-7 экзон мРНК) и 1-6 кодирующий экзон (2-7 экзон мРНК) (рис. 5).
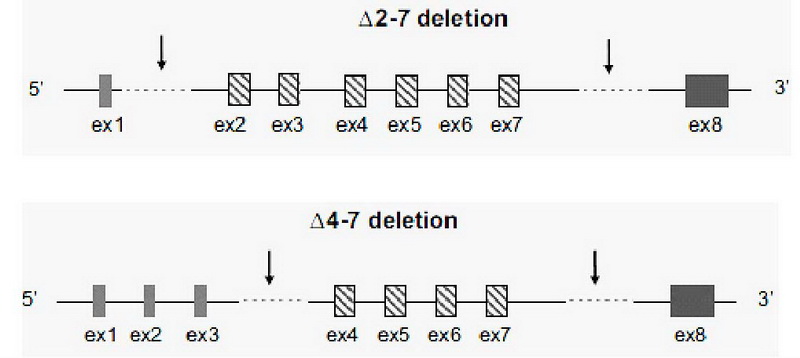
Анализ делеций в локусе IKZF1 выполнялся двумя методами: традиционной ПЦР и методом RQ-PCR. В изучаемой группе ОЛЛ был выполнен скрининг двух наиболее частых типов делеций в локусе IKZF1 - делеции, включающие 3-6 кодирующий экзон (4-7 экзон мРНК) и 1-6 кодирующий экзон (2-7 экзон мРНК). Для этого использовались оба описанных выше метода - классическая ПЦР для всех образцов и RQ-PCR для сомнительных случаев, подтверждения данных электрофореза и при наличии сверхэкспрессии коротких изоформ Ikaros.
Делеция в локусе IKZF1 была выявлена у 26 из 172 пациентов с ОЛЛ (15%). В половине этих случаев делеция выявлялась методом RQ-PCR в минорных субпопуляциях лейкозных бластов (менее 1% клеток). За исключением одного случая Т-ОЛЛ, в котором определялась делеция IKZF1 методом RQ-PCR на уровне 10-4, делеции были характерны для В-линейного ОЛЛ и составляли 25 из 147 (17%) этой группы.
В 25 из 26 случаев ОЛЛ была выявлена делеция ΔEx3-6, в трех случаях делеция ΔEx1-6 (у двух пациентов обнаружены две делеции одновременно). В одном случае ОЛЛ делеция ΔEx1-6 обнаруживалсь в субклоне. У одного пациента П-к делеция ΔEx1-6 была выявлена при первичном диагнозе и ей сопутствовала также делеция ΔEx3-6. Примечательно, что при рецидиве заболевания у этого пациента делеция ΔEx1-6 не выявлялась, а делеция ΔEx3-6 присутствовала, но как показал анализ нуклеотидной последовательности, иная, чем при первичном диагнозе. Это говорит о том, что две или все три делеции происходят из разных клонов лейкозных клеток. О биаллельных и олигоклональных делециях IKZF1 уже сообщалось ранее.
7. Связь между делециями в локусе IKZF1 и аберрантным сплайсингом Ikaros
Мы проанализировали соотношения между делециями в гене IKZF1 и экспрессией коротких изоформ гена Ikaros. Высказаны две гипотезы возникновения аберрантной экспрессии коротких изоформ гена Ikaros. Согласно первой, F. Klein et al., такой альтернативный сплайсинг является результатом эпигенетического воздействия, в т. ч. вызванного биохимическими эффектами химерного онкогена BCR/ABL. Другой точки зрения придерживается проф. C. Mullighan et аl., указывая единственной причиной аберрантного сплайсинга наличие делеций в гене.
Всего 115 пациентов с ОЛЛ были проанализированы на уровне ДНК на наличие генных делеций и на уровне РНК на экспрессию коротких изоформ гена Ikaros. Полученные результаты представлены в табл.
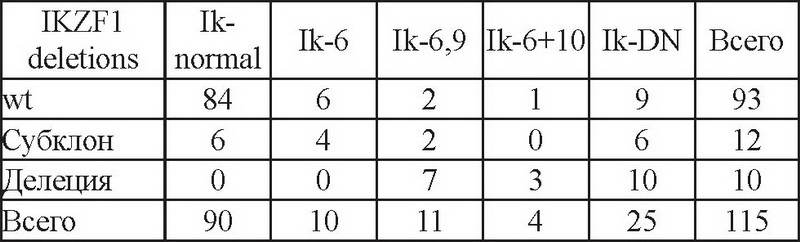
Примечание: субклон означает наличие делеции в минорных субклонах опухолевых клеток
Как видно из таблицы, наличие делеции в локусе IKZF1 сильно ассоциировано со сверхэкспрессией коротких изоформ (p<0,0001, Chi-квадрат). В отсутствии делеции только у 9 из 93 обследованных с ОЛЛ (9,7%) встречалась сверхэкспрессия Ik-DN, причем в 7 случаях это была только экспрессия Ik6, а еще в 2 случаях - сверхэкспрессия Ik6 и Ik9. При наличии делеции, из 10 пациентов с ОЛЛ была сверхэкспрессия у 7 - Ik6 и Ik9, еще у 3 пациентов - еще и Ik10. В случаях ОЛЛ с делецией в минорных субклонах опухолевых клеток была промежуточная ситуация - в 6 случаях был нормальный профиль экспрессии Ikaros, в 6 - сверхэкспрессия Ik-DN.
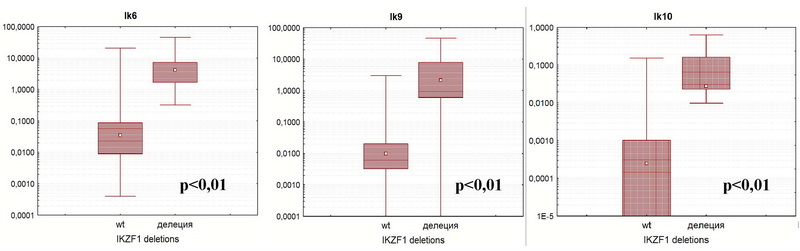
Нами были проанализированы различия в количественном уровне экспрессии отдельных изоформ гена Ikaros в группах ОЛЛ с наличием и отсутствием делеции (рис. 6). Экспрессия длинных изоформ Ikaros была несколько снижена при наличии делеции (достоверно для Ik1 и Ik4). Ik8 также был несколько снижен при делеции, что вновь характеризует Ik8 как физиологическую изоформу. При этом сверхэкспрессия коротких изоформ очень сильно коррелировала с наличием делеций. Это справедливо в равной степени для Ik6, 9, 10.
Таким образом, можно заключить, что фенотипические проявления делеций в гене Ikaros, вызванные делециями в его локусе, связаны не с падением экспрессии гена в целом (длинных изоформ), а именно сверхэкспрессии коротких изоформ. Однако вопрос о причинах и механизмах аберрантного сплайсинга в отсутствии делеций остается открытым.
Была разработана панель праймеров и флуоресцентно меченных TaqMan-зондов, позволяющая измерять с помощью метода RQ-PCR экспрессию 9 изоформ гена Ikaros. Дизайн исследования был оптимизирован и унифицирован всего для 2 зондов. Первый, Ex4_TM, меченный флуоресцентной меткой JOE, применялся для определения изоформ Ik1, Ik3, Ik2, Ik4. Второй, Ex7-5’TM, меченный флуоресцентной меткой ROX, применялся для выявления коротких изоформ Ik5, Ik8, Ik6, Ik9, Ik10.
В лейкозных клетках профиль экспрессии изоформ гена Ikaros в большинстве случаев сходен с таковым для нормального костного мозга. При этом отмечено некоторое уменьшение уровня экспрессии изоформ гена Ikaros относительно здорового костного мозга. В лейкозных клетках достоверно снижена экспрессия Ik2, Ik4 и Ik8.
Аберрантная сверхэкспрессия изоформ Ik6, Ik9, Ik10 была выявлена в 24, 11 и 4 случаев ОЛЛ соответственно. Это основное качественное изменение в экспрессии гена Ikaros, обнаруженное главным образом при В-линейном ОЛЛ (30%). Во всех случаях сверхэкспрессия изоформы Ik9 или Ik10 сопутствовала Ik6, что говорит об их сцепленном характере регуляции этих изоформ. В 9 из 25 случаев Ik-DNлейкозов сверхэкспрессия Ik6 была единственной короткой изоформой.
Делеция в локусе IKZF1 была выявлена у 26 из 172 пациентов с ОЛЛ (15%). В половине этих случаев делеция выявлялась методом RQ-PCR в минорных субпопуляциях лейкозных бластов (менее 1% клеток). За исключением одного случая Т-ОЛЛ делеции были характерны для В-линейного ОЛЛ и составляли 25 из 147 (17%) в этой группе. В 25 из 26 случаев ОЛЛ была выявлена делеция ΔEx3-6, в трех случаях делеция ΔEx1-6.
Примечательно, что мутации IKZF1 часто охватывают не всю субпопуляцию лейкозных клеток, но возникают в субпопуляциях лейкозных клеток. Это указывает на то, что аберрации IKZF1 не являются инициальными, патогенетическими событиями, а возникают в ходе прогрессии заболевания как вторичные события. Это подтверждается также нестрогим наследованием аберраций IKZF1 в парных случаях первичный - рецидив или первый и второй рецидив. Отмечены случаи, когда делеции IKZF1 или сверхэкспрессия Ik-DN изоформ пропадали или появлялись при рецидиве заболевания.
Сверхэкспрессия Ik-DN изоформ является основным проявлением нарушений в гене IKZF1 при лейкозах на уровне транскрипции и сплайсинга. По нашим данным, сверхэкспрессия Ik-DN сильно ассоциирована с наличием внутригенных делеций в локусе IKZF1. Подтверждается, что делеция 3-6 экзонов этого гена, соответствующих ДНК-связывающему домену белка Ikaros, приводит к сплайсингу оставшихся экзонов с образованием Ik6, Ik9, Ik10. Однако эти изоформы обнаруживались и в некоторых случаях ОЛЛ без делеции. Можно допустить, что у этих пациентов были делеции IKZF1, не выявляемые используемыми методами или что какие-то другие мутации или эпигенетические факторы приводят к сверхэкспрессии Ik-DN изоформ
Область применения: клиническая гематология, молекулярная генетика
Предложения по сотрудничеству: включение анализа IKZF1 гена в работу организаций здравоохранения, проводящих диагностику и лечение острых лейкозов