УДК: 616.155.392.8-036.11-018:578.264.3]-08
Год издания: 2013
Изучение спектра альтернативных форм сплайсинга пре-мРНК гибридного онкогена AML1/ETO в лейкозных клетках пациентов с ОМЛ, содержащих транслокацию t (8;21)(q22;q22), на протяжении курса терапии
Мигас А.А., Мишкова О.А., Алейникова О.В., Гринев В.В., Романовская Т.В.
Рубрики: 34.15.23
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Анализ альтернативных форм сплайсинга пре-мРНК гибридного онкогена AML1/ETO в клетках острого миелоидного лейкоза, содержащих транслокацию t(8;21)(q22;q22)» в рамках ГПНИ «Фундаментальная и прикладная медицина и фармация», подпрограмма «Фундаментальная и прикладная медицина».
Сроки выполнения НИР: 2011–2013 гг.
Научный руководитель: д-р мед. наук, проф., чл.-кор. НАН Беларуси О.В. Алейникова
Источник финансирования: госбюджет
Острый миелоидный лейкоз (ОМЛ) - это гетерогенное заболевание, которое классифицируется на основании наличия специфических цитогенетических аномалий, т. е. согласно Франко-Америко-Британской (FAB) классификации лейкемических клеток и иммунофенотипов. Одна из наиболее часто идентифицируемых в случаях лейкемии транслокаций располагается между хромосомными сегментами 8q22 и 21q22. Такая транслокация ассоциирована примерно в 40% случаев FAB-M2 ОМЛ и в 8-20% всех случаев ОМЛ в зависимости от генетических предпосылок и географии популяции. Транслокация (8;21) также наблюдается примерно в 6% случаев ОМЛ М1 и гораздо реже в ОМЛ М0, М4, М5 и других миелоидных неоплазиях. Хотя для взрослых пациентов транслокация (8;21) является маркером, указывающим на более благоприятный прогноз, для детей вероятность долгосрочной ремиссии составляет около 30%.
Несмотря на обширные данные литературы, на сегодняшний день нет четкого представления о многообразии РНК-продуктов гибридного онкогена AML1/ETO в клетках ОМЛ и их функциональной значимости при ОМЛ. Кроме того, до конца не ясна прогностическая значимость уровня экспрессии гибридного онкогена AML1/ETO и индивидуального спектра его РНК-продуктов для пациентов, больных ОМЛ с транслокацией t(8;21)(q22;q22).
Исходя из вышесказанного, нами была сформулирована следующая цель - изучить спектр альтернативных форм сплайсинга пре-мРНК гибридного онкогена AML1/ETO в лейкозных клетках пациентов, больных ОМЛ, содержащих транслокацию t(8;21)(q22;q22), на протяжении курса терапии.
Первой задачей, стоявшей перед нами в ходе данного исследования, была экспериментальная верификация альтернативных точек терминации транскрипции гибридного гена RUNX1/RUNX1T1 с помощью специфических обратных праймеров в клетках острого миелоидного лейкоза, содержащих транслокацию t(8;21)(q22;q22).
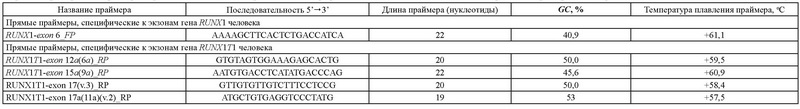
На данном этапе экспериментальной верификации предсказаний новой описательной биоинформационной модели гибридного гена RUNX1/RUNX1T1 мы сосредоточились на четырех областях предполагаемой терминации транскрипции, идентифицированных путем анализа полноразмерных кДНК гена RUNX1T1 из баз данных GenBank и dbEST. Эти области соответствуют3’UTR-экзонам 12а(6а), 15а(9а), 17а(11а) и 17 гена RUNX1T1. Наличие в клетках положительной по транслокации t(8;21)(q22;q22) формы острого миелоидного лейкоза транскриптов гибридного гена RUNX1/RUNX1T1, терминированных по указанным экзонам, подтверждалось с помощью ПЦР. В качестве матрицы для ПЦР использовалась кДНК, полученная с помощью реакции обратной транскрипции тотальной РНК из лейкозных клеток. Затравками в ПЦР служили пары праймеров, одним из которых был прямой праймер RUNX1-exon 6_FP, направленный к экзону 6 гена RUNX1, а вторым - один из обратных праймеров, направленных к указанным выше областям предполагаемой терминации транскрипции. Характеристика всех использованных на данном этапе работы праймеров представлена в табл. 1.
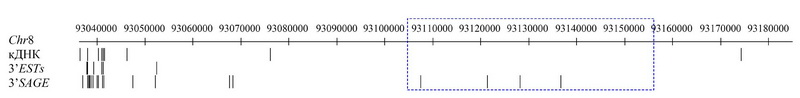
Ген RUNX1T1 человека транскрибируется с антисмысловой цепи. Область этого гена, вовлеченная в рекомбинационные события при транслокации t(8;21)(q22;q22), взята в пунктирный прямоугольник. Все потенциальные сайты терминации транскрипции, которые могут входить в состав гибридного гена RUNX1/RUNX1T1, располагаются слева от рекомбинационной области

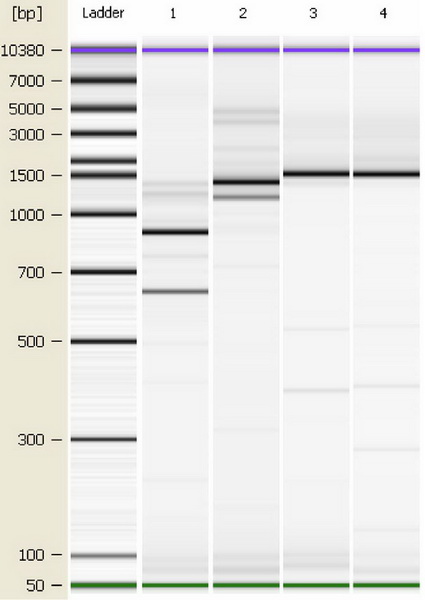
ПЦР была остановлена в фазе плато (30-й цикл амплификации). Один микролитр каждой пробы был проанализирован на приборе Agilent 2100 Bioanalyzer с использованием набора реагентов Agilent DNA 7500 Kit (Agilent Technologies GmbH, Германия). Дорожка 1: амплификация с парой праймеров RUNX1-exon 6_FP и RUNX1T1-exon 12a(6a)_RP. Дорожка 2: амплификация с парой праймеров RUNX1-exon 6_FP и RUNX1T1-exon 15a(9a)_RP. Дорожка 3: амплификация с парой праймеров RUNX1-exon 6_FP и RUNX1T1-exon 17a(11a)(v.1)_RP. Дорожка 4: амплификация с парой праймеров RUNX1-exon 6_FP и RUNX1T1-exon 17(v.1)_RP
Как это показано на рис. 2, продукты амплификации были разделены с помощью полиакриламидного гель-электрофореза, элюированы и секвенированы. Для всех изученных потенциальных областей терминации транскрипции гибридного гена RUNX1/RUNX1T1 было подтверждено наличие специфических РНК-продуктов. При этом нами пока не обнаружено включение 3’UTR-экзонов 12а(6а), 15а(9а), 17а(11а) и 17 гена RUNX1T1 в качестве внутренних экзонов в состав гибридной РНК.
Таким образом, при транскрипции гибридного гена RUNX1/RUNX1T1 помимо канонической области терминации в районе 3’UTR-экзона 17 гена RUNX1T1 могут использоваться еще как минимум три области для прекращения транскрипции - в районе 3’UTR-экзонов 12а(6а), 15а(9а) и 17а(11а). Без сомнения, благодаря этим дополнительным областям терминации должен расшириться репертуар РНК-транскриптов гибридного гена.
Следовательно, нами было принято решение более глубоко изучить соотношение AE, AE6a и AE9a, AE17, AE17a РНК-транскриптов гибридного онкогена RUNX1/RUNX1T1 в клетках пациентов с ОМЛ с транслокацией t(8;21)(q22;q22) до начала и после завершения курса терапии. На данный момент, для гибридного онкогена RUNX1/RUNX1T1 описано огромное разнообразие альтернативных транскриптов. Влияние полноразмерного транскрипта AE и продукта его экспрессии на процесс патогенеза ОМЛ уже достаточно хорошо изучено, чего нельзя сказать об альтернативных изоформах. Несмотря на это в последнее время наблюдается существенный прогресс в понимании механизмов, посредством которых данные транскрипты влияют на процесс лейкемогенеза. Одними из таких транскриптов являются AE6a и AE9а (рис. 3).
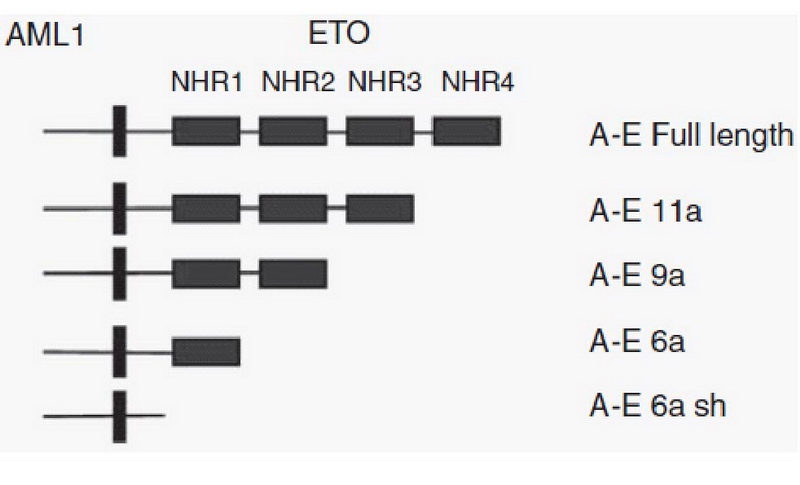
Как видно из приведенного рис., транскрипты AE6a и AE9a не включают в свой состав последовательности, кодирующие ряд ключевых для гибридного онкогена RUNX1/RUNX1T1 белковых доменов. Несмотря на этот факт для обеих изоформ получены предварительные данные, свидетельствующие в пользу их важности в процессе лейкемогенеза. Согласно экспериментальным данным, полученным на мышиных моделях, транскрипт, включающий экзон 6а, увеличивает клоногенный потенциал клеток, позитивных по t(8;21)(q22;q22). Наличие транскрипта, включающего экзон 9а, способствует более быстрому развитию лейкоза с блоком дифференцировки клеток на более ранних стадиях, а также, предположительно, более вероятному рецидиву.
Таким образом, основываясь на описанных выше результатах исследований, мы поставили перед собой задачу изучить особенности экспрессии данных транскрипционных вариантов AE6a, AE9a, AE17a, AE17 гибридного онкогена RUNX1/RUNX1T1 в группе пациентов с ОМЛ, позитивных по транслокации t(8;21).
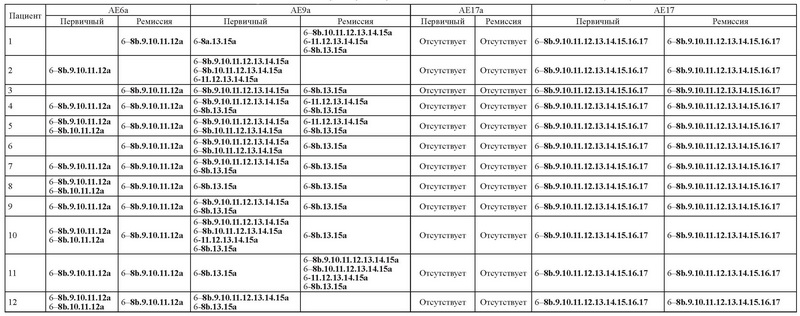
Для предварительной оценки экспрессии транскрипционных вариантов AE, AE6a и AE9а гибридного онкогена RUNX1/RUNX1T1 в образцах пациентов с ОМЛ, позитивных по транслокации t(8;21), нами были отобраны двенадцать соответствующих случаев (табл. 2).
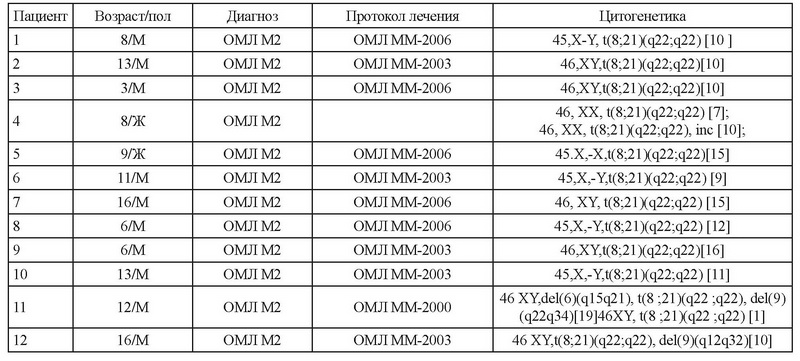
Для каждого пациента анализ проводился в двух точках: на момент постановки диагноза и в состоянии ремиссии. Оценка экспрессии анализируемых изоформ проводилась методом ПЦР на кДНК пациентов. В качестве прямого праймера использовался праймер к 6 экзону гена RUNX1, в качестве обратного для полного транскрипта AE - праймер к 17 экзону гена RUNX1T1, для транскрипта AE6a - к 6а экзону гена RUNX1T1, для транскрипта 9а - к 9а экзону гена RUNX1T1, для транскрипта 17а - к 17а экзону гена RUNX1T1 (табл. 3).
После того, как нами были идентифицированы наиболее вероятные области терминации транскрипции, отработанный для модельной клеточной линии Kasumi 1 подход (рис. 2) мы применили для анализа спектра альтернативных форм сплайсинга пре-мРНК гибридного онкогена RUNX1/RUNX1T1 в лейкозных клетках 12 пациентов с ОМЛ, содержащих транслокацию t(8;21)(q22;q22), на протяжении курса терапии.
Полученные в результате проведенных ПЦР фрагменты были очищены в полиакриламидном геле и идентифицированы с помощью секвенирования. В результате для каждого пациента нами был получен профиль возможных транскриптов, на момент постановки диагноза и по достижении ремиссии оканчивающихся на экзоны 6а, 9а, 17, 17а (табл. 4).
Для всех пациентов наблюдалась амплификация фрагмента полноразмерного транскрипта АЕ как в материале, взятом на момент постановки диагноза, так и в период, когда пациент находился в клинической и морфологической ремиссии. Полученные результаты согласуются с данными литературы. Неоднократно описаны случаи обнаружения химерного онкогена RUNX1/RUNX1T1 методом ОТ-ПЦР в образцах пациентов, находящихся в длительной цитогенетической и морфологической ремиссии.
Транскрипты, оканчивающиеся на экзон 17а, не были обнаружены ни в одном из образцов. Лишь для модельной клеточной линии наблюдалась амплификация фрагмента транскрипта AE17a. Вероятно, включение экзона 17a в транскрипты химерного онкогена RUNX1/RUNX1T1 является достаточно редким событием, если учесть, что согласно нашим данным, он наблюдался лишь в 1 из 13 образцов.
Фрагменты транскриптов с экзоном 6а в нашем исследовании наблюдались у большей части пациентов как в первичных образцах, так и в материале, взятом на момент ремиссии. Интересно отметить в трех случаях: 1, 3 и 6 транскрипты, содержащие данный экзон, обнаруживались лишь в ремиссии. Согласно данным литературы, включение экзона 6а в транскрипты химерного онкогена RUNX1/RUNX1T1 увеличивает клоногенный потенциал клеток.
Транскрипты, оканчивающиеся на экзон 9а, обнаруживались в образцах всех 12 пациентов на момент постановки диагноза. Проведенные ранее исследования показали, что в группе пациентов, в образцах которых обнаруживались транскрипты данного типа, риск рецидива повышен по отношению к группе без данного типа транскриптов. В нашей группе подобной корреляции не наблюдалось, так как все 12 пациентов, включенных в исследование, находятся в ремиссии, и ни у одного не наблюдалось рецидивов. Можно предполагать, что подобные различия в результатах между нашими исследованиями и ранее опубликованными данными были получены по причине разницы в чувствительности подходов. Вероятно, что используемый нами подход является более чувствительным и с большей вероятностью обнаруживает транскрипты, представленные в клетке в очень небольшом количестве.
Достижения Таким образом, можно предположить, что не только наличие транскриптов, оканчивающихся на экзоны 6а и 9а гена RUNX1T1, но и их количество играет определенную роль в дальнейшем течении заболевания. Следовательно, дальнейшее изучение спектра альтернативных форм сплайсинга пре-мРНК гибридного онкогена AML1/ETO методами количественной ПЦР позволят уточнить прогностическую значимость обнаруженных нами вариантов транскриптов. Данные количественных исследований также лягут в основу модифицированного варианта метода диагностики минимальной остаточной болезни у прошедших курс лечения пациентов с ОМЛ, положительным по транслокации t(8;21)(q22;q22).

Новизна: изучен спектр альтернативных форм сплайсинга пре-мРНК гибридного онкогена RUNX1/RUNX1T1 в лейкозных клетках пациентов, больных ОМЛ, содержащих транслокацию t(8;21)(q22;q22), на протяжении курса терапии и в состоянии ремиссии.
Область применения: онкология, гематология, трансфузиология
Рекомендации по использованию: полученные данные лягут в основу модифицированного варианта метода диагностики минимальной остаточной болезни у прошедших курс лечения пациентов с ОМЛ, положительным по транслокации t(8;21)(q22;q22)
Предложения по сотрудничеству: результаты, полученные в ходе выполнения проекта, перспективны в плане дальнейшего практического применения, могут быть могут быть использованы в фундаментальных исследованиях по биологии опухолевой клетки, а также внедрены в практику учебных учреждений