УДК: 616.155.392-036.11:575.224.22
Год издания: 2013
Анализ распространенности генных мутаций FLT3, NPM1, CEBPA и p53 в группе пациентов с острым нелимфобластным лейкозом
Силин А.Е., Мартинков В.Н., Новик Д.К., Козич Ж.М., Тропашко И.Б., Шпудейко В.К., Силина А.А., Воропаева А.В., Мартыненко С.М.
Рубрики: 76.03.39
Республиканский научно-практический центр радиационной медицины и экологии человека
Тема НИР: «Провести анализ распространенности наиболее значимых генных мутаций и хромосомных аберраций в группах взрослых пациентов с миелодиспластическим синдромом и острым нелимфобластным лейкозом».
Сроки выполнения НИР: январь 2011 г. — декабрь 2013 г.
Научный руководитель: канд. биол. наук А.Е. Силин.
Источник финансирования: госбюджет.
Важной составляющей лечения острых нелимфобластных лейкозов (ОНЛЛ) является своевременный прогноз заболевания и оценка на каждом из этапов лечения эффективности терапии.
В настоящее время особое внимание уделяется поиску молекулярно-генетических маркеров при ОНЛЛ. По данным различных исследований, ОНЛЛ часто сопровождается соматическими мутациями ряда генов. К их числу относятся ген FLT3, мутации которого (FLT3-ITD и FLT3 D835), по данным литературы, определяют неблагоприятный прогноз, ген NPM1 (благоприятный прогноз, кроме случаев сочетания с мутациями FLT3), ген CEBPA (благоприятный прогноз) и ген p53 (неблагоприятный прогноз).
Цель - анализ вклада мутаций генов FLT3, NPM1, CEBPA и p53 в формирование оценки прогноза заболевания у пациентов с ОНЛЛ и миелодиспластическим синдромом МДС (вариант - рефрактерная анемия с избытком бластов, РАИБ).
В целом в исследовании на добровольной основе приняли участие 120 пациентов, проходивших лечение в период 2009-2013 гг. в гематологическом отделении для взрослых ГУ «РНПЦ РМиЭЧ». В зависимости от диагноза данные пациенты разделены на две группы - МДС РАИБ и ОНЛЛ. Группа пациентов с МДС включала 23 человека - 14 мужчин и 9 женщин; средний возраст 58 лет. Группа с ОНЛЛ сформирована из 97 пациентов, из них 38 мужчин и 59 женщин; средний возраст 54 года.
По классификации FAB группа исследования из числа пациентов с ОНЛЛ подразделялась на 5 подгрупп (М0-М4).
Мутации FLT-ITD и NPM1 анализировали методом ПЦР со специфическими праймерами, фланкирующими 14-15 экзоны гена FLT3 и 11 интрон-12 экзон гена NPM1 с последующей электрофоретической детекцией в 2,7% агарозном геле с окраской бромистым этидием. Мутацию FLT3 D835 анализировали посредством метода RFLP-PCR с рестриктазой EcoRV. Мутации гена CEBPA выявляли методом SSCP-PCR в пределах всей кодирующей последовательности гена посредством 12% неденатурирующего полиакриламидного гель-электрофореза с окраской серебром. Таким же методом анализировали мутации гена p53 в пределах 5-9 экзонов. Для идентификации мутаций генов CEBPA и р53 проводили секвенирование с прямым и обратным праймерами посредством генетического анализатора AB3500.
В результате молекулярно-генетического анализа в группе пациентов с МДС РАИБ было выявлено два случая соматических мутаций FLT3-ITD (8,7±5,9%), а также два случая мутации NPM1 (8,7±5,9%).
При ОНЛЛ было выявлено 50 случаев наличия в крови и/или костном мозге различных мутаций из числа анализируемых: в 22 случаях (22,7±4,3%) - мутация FLT-ITD, в 21 (21,6±4,2%) - мутация гена NPM1, в клиническом материале 7 пациентов (7,2±2,6%) - мутация D835 гена FLT3.
Наблюдались различия в составе и частоте встречаемости анализируемых мутаций в различных подгруппах пациентов с ОНЛЛ (рис. 1).
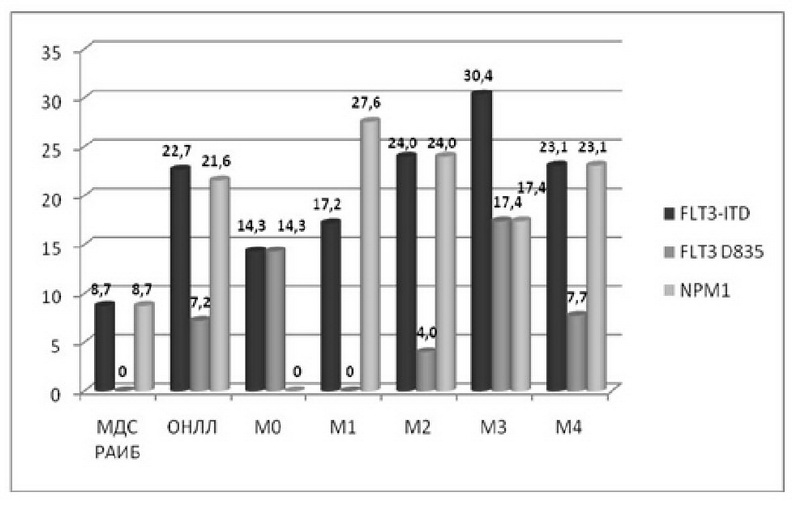
В ходе SSCP-анализа гена CEBPA в целом были выявлены 14 случаев подтвержденных секвенированием мутаций, которые встречались только в группе ОНЛЛ. У трех пациентов были выявлены по две мутации, локализованные в различных анализируемых фрагментах. В подавляющем большинстве наблюдений выявлены мутации в виде инсерций или делеций, включая относительно крупные - от 3 до 18 пар нуклеотидов. Также отмечены 4 случая однонуклеотидных замен. При этом в трех случаях мутация представляла собой синонимическую замену g.5512G>A, что предположительно не может привести к клинически значимому эффекту. В одном случае присутствовала несинонимическая замена g.6027G>C, приводящая к изменению кодирующей последовательности p.Arg306Pro.
Распределение выявленных мутаций по группам и подгруппам исследования было неравномерным (рис. 2). Расчеты произведены по числу пациентов с мутациями (11 случаев) без учета двойных мутаций.
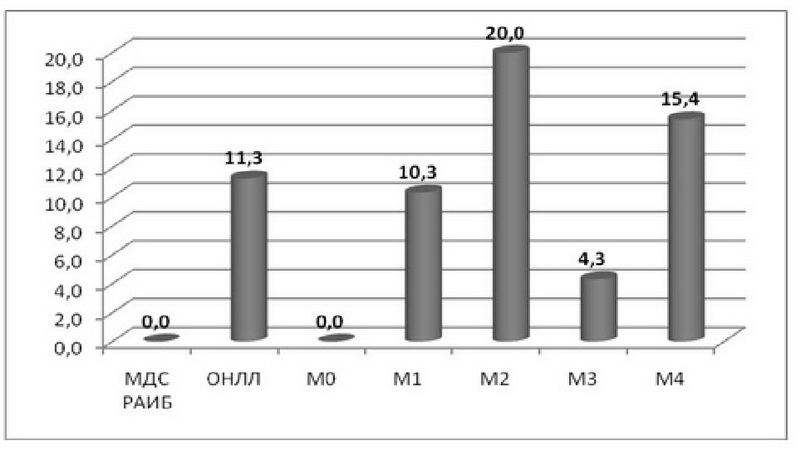
В ходе анализа ДНК, выделенной из костного мозга 120 пациентов, выявлены 17 случаев подтвержденных секвенированием соматических мутаций гена р53, локализованных в пределах 5-9 экзонов. При этом у трех пациентов были выявлены одновременно по две различные мутации. Распространенность мутаций гена р53 по подгруппам наглядно представлена на рис. 3.
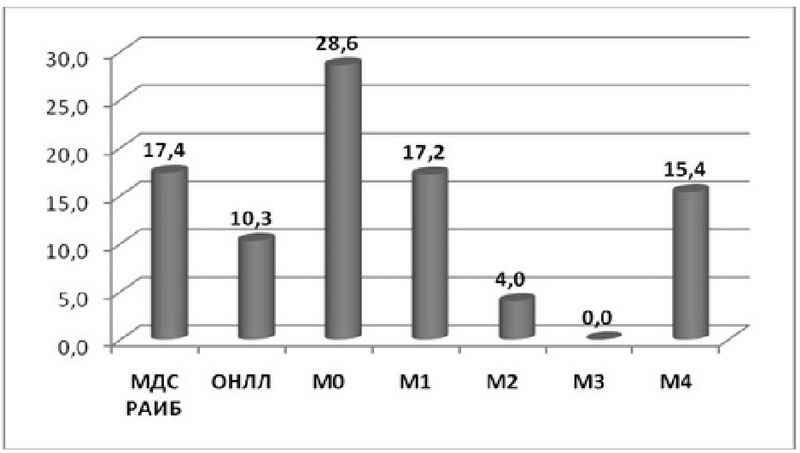
Для того чтобы оценить, какой вклад могут внести исследуемые нами мутации в оценку прогноза и эффективности лечения и насколько они дополнят традиционный спектр цитогенетических маркеров, был проведен анализ сопряженности выявленных мутаций и хромосомных аберраций в исследуемых группах и подгруппах пациентов с МДС РАИБ и ОНЛЛ.
В соответствии с протоколом диагностики ОНЛЛ в пределах исследуемой группы (МДС РАИБ+ОНЛЛ) был проведен молекулярно-генетический анализ хромосомных транслокаций t(8;21)(q22;q22), t(15;17)(q22;q21) и inv(16)(p13;q22), а также цитогенетический анализ хромосомных аберраций. В результате только у 25 пациентов выявлена какая-либо хромосомная аберрация, что составляет 20,8±3,7%.
При использовании в качестве маркеров только мутации FLT3 и NPM1 охватывается группа из 39 пациентов (32,5±4,3%). Добавление в тестирование мутаций CEBPA и р53 без хромосомных аберраций увеличивает группу с прогностическими маркерами до 60 человек (50,0±0,6%).
Совместное использование при тестировании всех анализируемых мутаций и хромосомных аберраций позволяет охватить прогностическими маркерами группу из 72 пациентов, что составляет 60,0±0,7%. Таким образом, использование молекулярно-генетических маркеров позволяет расширить общую группу с какими-либо прогностическими характеристиками почти на 40%.
В отдельной группе пациентов с ОНЛЛ количество выявленных хромосомных аберраций составило 21 из 97 обследованных (21,6±0,5%).
При совместном использовании всех анализируемых соматических мутаций группа с маркерами прогноза и эффективности лечения включает 51 пациента из 97 (52,6±0,7%).
Совместное использование всех анализируемых маркеров, включая хромосомные аберрации, позволяет охватить прогностическими маркерами группу из 61 пациента с ОНЛЛ (62,9±0,8%). Иными словами, использование молекулярно-генетических маркеров совместно с цитогенетическими расширяет группу с прогностическими маркерами на 41,3% относительно только цитогенетических данных. Таким образом, тестирование молекулярно-генетических маркеров существенно улучшает оценку прогноза пациентов с ОНЛЛ и более эффективно контролирует процесс лечения.
Область применения: онкогематология.
Рекомендации по использованию: молекулярно-генетический анализ соматических мутаций генов FLT3, NPM1, CEBPA и p53 может быть использован для оценки прогноза и эффективности лечения пациентов с ОНЛЛ без цитогенетических нарушений.
Предложения по сотрудничеству: совместные исследования, поиск дополнительных маркеров для оценки прогноза и эффективности лечения с ОНЛЛ.