УДК: 616.42–006.55:[612.017.1:616–008]–085–053.2
Год издания: 2015
Динамика восстановления лимфоцитарного звена после применения сиролимуса для лечения генерализованной лимфаденопатии у ребенка с первичным комбинированным иммунодефицитом
Шарапова С.О., Гурьянова И.Е., Алешкевич С.Н., Алейникова О.В.
Рубрики: 76.03.39, 76.29.47
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Разработать и внедрить методы диагностики иммунологической толерантности у пациентов с первичными иммунодефицитами для повышения эффективности иммунотропной терапии».
Сроки выполнения НИР: 2013—2015 гг.
Научный руководитель: канд. биол. наук, доц. М.В. Белевцев.
Источник финансирования: госбюджет.
Цель- изучить динамику восстановления В- и Т-лимфоцитарного звена после иммунотропной терапии для лечения дисрегуляции у пациента с комбинированным иммунодефицитом (синдром активации фосфоинозид 3- киназы δ (Activated phosphоinositid 3-kinase syndrome).
Сиролимус, известный также как рапамицин, - иммунодепрессант , применяемый для того, чтобы избежать отторжений органов при трансплантации; часто он используется при почечных трансплантациях. Он предотвращает активацию T- и B- клеток , подавляя их ответ на интерлейкины-2 (IL-2). Сиролимус активно используется при стентировании . Он также показал эффективность при лечении аутоимунных заболеваний на мышах и у детей с редким аутоиммунно-лимфопролиферативным синдромом.
Сиролимус подавляет ответ на интерлейкин-2 и таким образом, препятствует активации T- и B- клеток. Сиролимус связывается с цитоплазматическим белком FK-binding protein 12 (FKBP12), в комплексе с которым подавляет mTOR путь, с помощью прямого связывания с mTOR комплексом 1 (mTORC1). В составе этого комплекса mTOR регулирует клеточный рост и выживание.
Доминантная активирующая (gain-of-function) мутация E1021K в гене PI(3)KCD приводит к развитию комбинированного иммунодефицита - синдрома активации фосфоинозитид 3-киназы δ (PI(3)K) 1 типа (activated phosphoinositide 3-kinase δ (APDS1)) (OMIM 602839) [Angulo I., et al., 2013]. Некоторые авторы называют это заболевание «болезнь PASLI» - синдром р110δ-активирующей мутации, приводящей к старению Т-клеток, лимфаденопатии и иммунодефициту (p110d-activating mutation causing senescent T cells, lymphadenopathy and immunodeficiency) [Lucas C.L., et al., 2014]. APDS1 был описан впервые в 2013 г. и по последней классификации первичных иммунодефицитов (ПИД) он был отнесен в две группы: комбинированные иммунодефициты; иммунодефициты с нарушением продукции антител (со снижением концентраций IgA, IgG с нормальным уровнем IgM и В-клеток) [Al-Herz W., et al., 2014]. Тип наследования APDS1 аутосомно-доминантный. К настоящему времени в литературе описано около 40 пациентов с GOF-мутацией в гене PI(3)KCD из Европы и США [Angulo I. et al., 2013; Lucas C.L. et al., 2014; Kracker S. et al., 2014].
Первые проявления синдрома стартуют в раннем детском возрасте с появления инфекций респираторного тракта или лимфопролиферативных изменений. Нарушение противоинфекционной резистентности у таких лиц ведет к развитию серьезных осложнений. У 100% пациентов формируются рецидивирующие инфекции ЛОР-органов и легких: отиты и синуситы - у 50-55%, тонзиллиты - у 26%, повторные бронхиты и пневмонии - у 88-90%, из них с формированием бронхоэктазов - у 75%. Лица с APDS1 предрасположены к инфекциям, вызываемым вирусами герпес-группы. Эпштейна-Барр (EBV) и/или цитомегаловирусная (CMV) инфекция развивается примерно у 70-80% пациентов. Чаще наблюдается виремия, реже - генерализация процесса. Инфекции, вызванные H.simplex и H.varicella zoster, выявляются у 10-15% пациентов. Описаны также поражения кожи в виде множественных бородавок, контаминация контагиозным моллюском. Грибковые инфекции кожи и слизистых оболочек отмечаются у 15% пациентов.
APDS1 ассоциирован с тяжелой лимфопролиферацией и нодулярной лимфоидной гиперплазией - описан у 50-60%. Часто лимфаденопатия и гепатоспленомегалия становятся первыми признаками заболевания. Характерно увеличение всех групп лимфоузлов, в т.ч. в лимфоглоточном кольце, что может привести к апноэ. Спленомегалия описана примерно у половины пациентов с APDS1, гепатомегалия - у 40%. В ¼ случаев тяжелой лимфаденопатии и гепатоспленомегалии не развивается. Нодулярная лимфоидная гиперплазия слизистых оболочек описана у 30% пациентов. Чаще очаги локализуются в бронхах и альвеолах или желудочно-кишечном тракте. Лимфоидная инфильтрация в легких приводит к прогрессирующей дыхательной недостаточности. Поражения кишечника сопровождаются клиникой энтероколита, мальабсорбцией, потерей в весе у детей [Angulo I. et al., 2013; Lucas C.L. et al., 2014].
Аутоиммунные и аутовоспалительные осложнения описаны у 44% пациентов. Чаще всего развиваются иммунные цитопении (23%), гломерулонефриты (6%), гепатиты/склерозирующие холангиты (6%), тиреоидиты (6%). У 25% описана хроническая энтеропатия [Angulo I. et al., 2013; Kracker S. et al., 2014].
Патогенетическим лечением лимфопролиферативных процессов при APDS1 и APDS2 является длительное применение специфических ингибиторов mTORC1-комплекса сиролимуса (рапамицина) и эверолимуса [Lucas C.L. et al., 2014].
Мы описываем клинические данные пациента с комбинированным иммунодефицитом (синдром активации фосфоинозид 3-киназы δ (Activated phosphоinositid 3-kinase syndrome), которому после установления генетического диагноза была назначена таргетная патогенетическая терапия ингибитором mTOR (сиролимус).
Письменное информированное согласие на проведение исследований было получено от матери пациента.
Иммунологические исследования периферической крови включали определение T, B, и NK лимфоцитов методом 7-цветной проточной терапии, дополнительно анализировали тимические мигранты (CD4+CD31+ CD45RA+), B-клетки памяти (CD19+CD27+IgD+/-), уровень сывороточных иммуноглобулинов.
Генетический анализ. Секвенирование проводили на автоматическом секвенаторе GeneticAnalyzer ABI 3130 (Hitachi, Япония).
Девочка от второй беременности, первых родов (первая беременность - выкидыш). Раннее психомоторное развитие с некоторой задержкой на 2-3 мес. Привита по возрасту. До 4 лет практически не болела. В 4 года после перенесенного бронхита было обнаружено увеличение размеров периферических лимфоузлов, при обследовании онкологический процесс был исключен. В течение последующих 6 мес. несколько раз перенесла ОРВИ, гнойные отиты, синуситы. В крови были обнаружены антитела IgM к хламидии и CMV. С 4 до 7 лет полиаденопатия имела прогрессирующее течение.
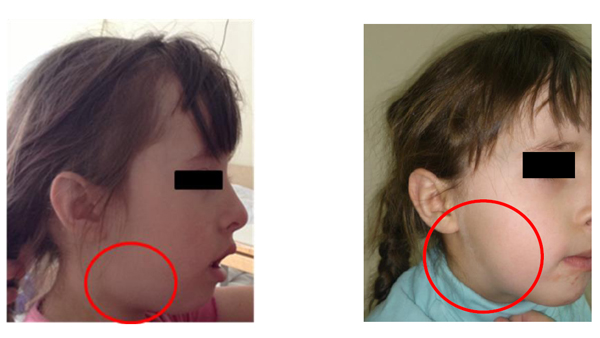
После выявления GOF-мутации в гене PI(3)KCD пациенту был назначен сиролимус. В течение 1 мес. терапии получен положительный эффект со стороны лимфопролиферативного процесса. На рисунке 1 представлен эффект от терапии в виде уменьшения размера подчелюстного лимфоузла до нормальных размеров через 5 недель после начала терапии.
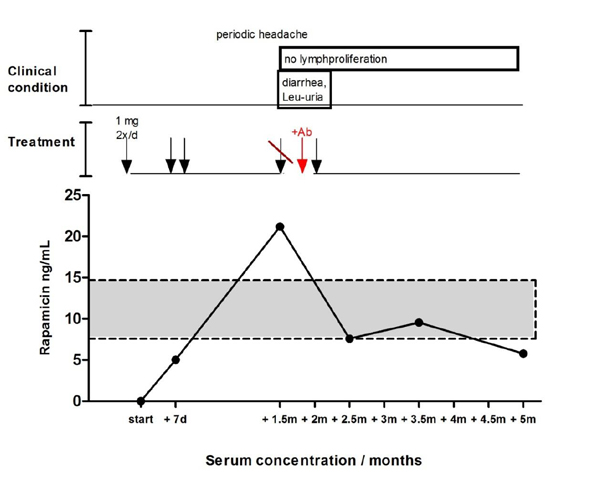
Клинический эффект после назначения лекарственного средства и достижения терапевтической концентрации в крови был замечен через 4 недели после старта терапии в виде уменьшения зрительно заметных лимфатических узлов. Терапевтически значимая концентрация была достигута ко второму месяцу терапии после коррекции дозы лекарственного средства. Из осложнений наблюдали диарею и лейкоцитурию через 1,5 мес. от начала терапии; применение сиролимуса было временно остановлено (рисунок 2).
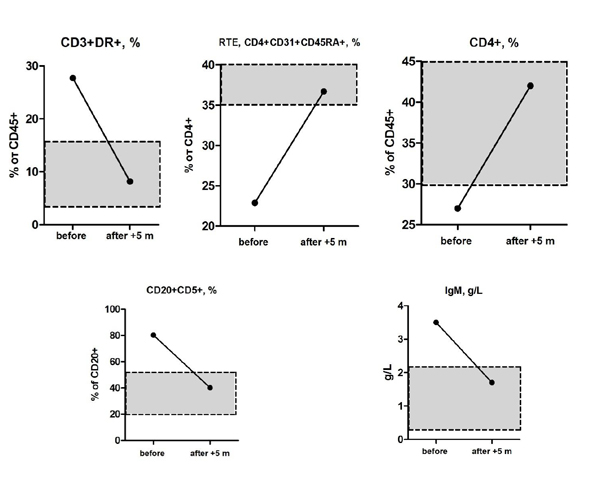
Впервые для лечения пациентов с первичным иммунодефицитом был применен ингибитор mTOR (сиролимус, рапамицин) для лечения тотальной лимфопролиферации у девочки с синдромом активации фосфоинозид 3-киназы δ. Клинический эффект в виде уменьшения размеров шейных, подмышечных и подчелюстных лимфоузлов наблюдали через 3 недели после назначения лекарственного средства. Иммунологический эффект от терапии был оценен через 5 мес. после старта терапии, его наблюдали в виде нормализации относительного содержания CD4+ Т-хелперов, тимических мигрантов, активированных Т-лимфоцитов, CD20+CD5+ B-лимфоцитов и уровня иммуноглобулина М.
Область применения: углубленная лабораторная диагностика первичных иммунодефицитов и оценка эффективности иммунотропной терапии.
Рекомендации по использованию: достижение внедрено в ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии» в виде методологии оценки эффективности иммунотропной терапии иммунных цитопений у детей.
Предложения по сотрудничеству: консультативная помощь при внедрении, совместные исследования.