УДК: 616.155.392-036.12-085:615.15-018-091.818.38
Год издания: 2015
Идентификация биологических свойств клеток при хроническом лимфоцитарном лейкозе, влияющих на течение заболевания
Свирновский А.И., Смирнова Л.А., Слобожанина Е.И., Тамашевский А.В., Цвирко Д.Г., Колбаско Л.В., Федуро Н.А., Сергиевич О.В., Тарас И.Б., Пасюков В.В., Бакун А.В.
Рубрики: 76.29.33
Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий
Тема НИР: «Разработать и внедрить технологию оценки клеточного репаративного ответа ex vivo для принятия индивидуализированных клинических решений при хроническом лимфоцитарном лейкозе».
Сроки выполнения НИР: 2012—2015 гг.
Научный руководитель: д-р мед. наук, проф. А.И. Свирновский, д-р мед. наук, проф. Л.А. Смирнова.
Соисполнители: Республиканский центр гематологии и пересадки костного мозга .
Источник финансирования: госбюджет.
Цель- оценить репаративный ответ клеток при хроническом лимфоцитарном лейкозе (ХЛЛ) ex vivo на лекарственные средства (ЛС) и определить содержание активных форм кислорода (АФК) в клетках для прогнозирования течения заболевания.
Сущность достижения заключается в выявлении роли устойчивости клеток при ХЛЛ к повреждению цитостатическими ЛС с последующим ответом пациентов на терапию, а также роли накопления АФК в клетках для оценки статуса пациентов.
Новизна исследования состоит в укорочении сроков принятия новых клинических решений и установлении связи между высоким содержанием АФК в клетках и неблагоприятным исходом заболевания.
ХЛЛ является самой распространенной и причем пока неизлечимой с помощью стандартной терапии формой лейкоза взрослых. При этом заболеваемость ХЛЛ возрастает, с одной стороны, за счет постарения населения (средний возраст пациентов при заболевании около 65 лет), а с другой - за счет выявления случаев и среди более молодых возрастных групп (около 10% заболевших в возрасте около 40 лет), что характерно не только для Беларуси, но и для стран Западной Европы и Северной Америки.
Предполагается, что новые подходы к исследованию проблемы ХЛЛ обеспечат разработку и внедрение технологии оценки клеточного репаративного ответа ex vivo, что позволит принимать персонифицированные клинические решения. При этом дополнительные методы исследования биологических свойств лейкозных клеток в конечном итоге могут привести к повышению клинической эффективности терапии ХЛЛ за счет снижения ее токсичности, а также стоимости лечения вследствие рационального использования дорогостоящих ЛС и создания системы оценки статуса пациентов при объективизации критериев выбора тактики ведения пациентов.
При этом имеется в виду, что оксидативный стресс играет особую роль в реализации цитотоксического эффекта в лейкозных клетках при ХЛЛ в связи с исходным повышенным содержанием АФК в этих лимфоцитах, хотя базальный уровень свободных радикалов в клетках характеризуется значительной гетерогенностью. Это неудивительно, так как двойственная роль АФК в физиологии и патологии клетки очевидна. Действительно, известно, что низкие и промежуточные уровни АФК способны даже защитить клетку от апоптоза путем активации антиоксидантных механизмов. Непреходящий интерес к метаболизму АФК при лейкозах связан еще и с тем, что манипуляции с АФК составляют суть одного из успешно развивающихся в последние годы подходов к терапии лейкозов, направленных на преодоление лекарственной резистентности, так как АФК могут выступать в качестве стрессовых факторов для ДНК.
Результаты определения ответа на лечение по общепринятым показателям в двух группах пациентов, которым проводили терапию без предварительного подбора или назначали ЛС, ингибирующие лейкозные клетки ex vivo, представлены в таблице 1. Они однозначно свидетельствуют о более высоком качестве ответа на терапию в случае ее индивидуального подбора.
Важно отметить, что выявленные различия между обеими группами сохранялись независимо от стадии заболевания и протокола терапии. Более того, возможно прогнозирование отдаленных результатов по выраженности ответа на начальном этапе терапии. При этом принятие решения о смене неэффективной терапии допустимо уже на третьем мес. Однако наличие тяжелых сопутствующих заболеваний у пациентов может сокращать возможности чувствительность-адаптированной терапии.
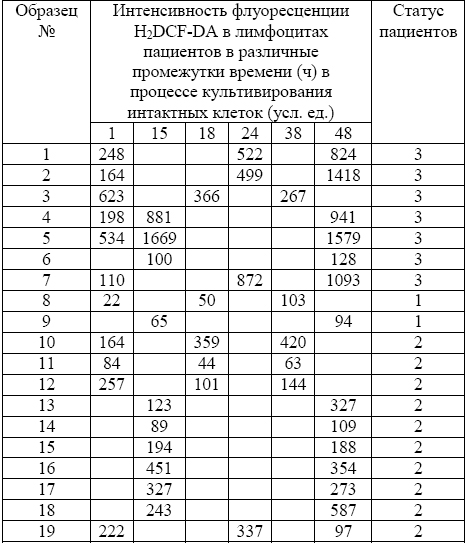
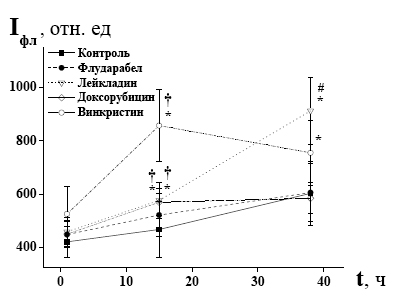
Одновременно установлено, что цитостатические ЛС способны индуцировать увеличение содержания АФК в клетках при их совместном культивировании (рисунок). Уровень накопления внутриклеточных свободнорадикальных соединений измеряли с использованием флуоресцентного зонда 2′,7′- дихлородигидрофлуоресцеиндиацетата (H2DCF-DA, Sigma). Для окрашивания лимфоциты (1х106 кл./мл) отмывали от цитостатических лекарственных средств в течение 5 мин при 300g и ресуспендировали в фосфатном буфере, содержащем H2DCF-DA в конечной концентрации 1x10-6 М. Инкубировали в течение различного времени в темноте при 37°С. Затем отмывали в фосфатном буфере (pH 7,4) в течение 5 мин при 300g и немедленно анализировали на проточном цитофлуориметре FACScan (BectonDickinson, США) в канале FL1-H. При этом оказалось, что исход заболевания может быть связан с содержанием АФК в клетках. В группе пациентов с летальным исходом этот показатель более чем в три раза превышал таковой в группе лиц в стадии неполной клинико-гематологической ремиссии или клинико-гематологической стабилизации.
Таблица 1 - Качество ответа на терапию пациентов с ХЛЛ в группе сравнения и основной группе
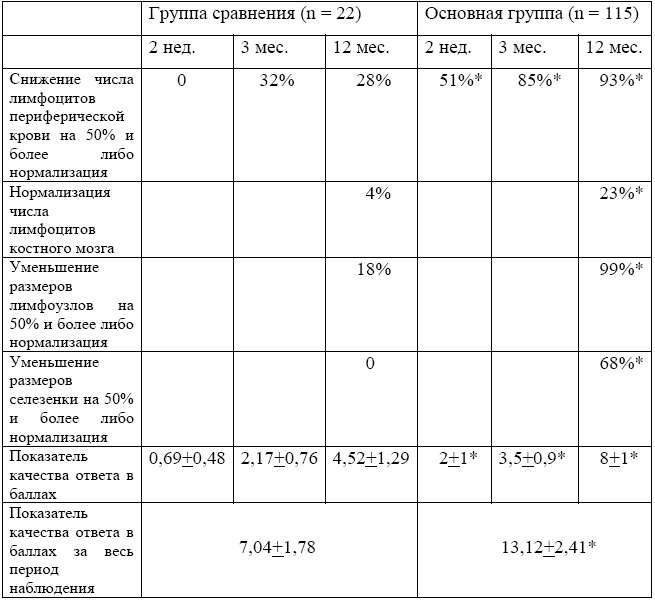
Таблица 2- Динамика образования АФК в лимфоцитах периферической крови пациентов с ХЛЛ в связи с их статусом
Рисунок
Область применения: онкогематология, фармакология.
Рекомендации по использованию: прогнозирование ответа и выбора терапии при ХЛЛ.
Предложения по сотрудничеству: совместные экспериментальные и клинические исследования при ХЛЛ.