УДК: 616.018.3+616.018.41+616.018.8]:616.013.395 -018
Год издания: 2015
Оптимизация протоколов дифференцировки мезенхимальных стволовых клеток в клетки костной и хрящевой ткани для использования в клинической практике
Космачева С.М., Дубовик Д.Л., Игнатенко С.И., Северин И.Н., Кувырков Е.В., Хулуп Г.Я.
Рубрики: 62.33.31, 76.29.33, 76.29.46
Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий
Тема НИР: «Разработка технологии дифференцировки мезенхимальных стволовых клеток, полученных из разных источников (костный мозг, жировая ткань, ткань пуповины) в клетки хрящевой, костной и нервной ткани и организация производства их биомассы для использования в клинической медицине».
Сроки выполнения НИР: май 2013 г. — декабрь 2015 г.
Научный руководитель: д-р мед. наук, проф. Г.Я. Хулуп, акад. НАНБ И.Д. Волотовский.
Источник финансирования: госбюджет.
В настоящее время мезенхимальные стволовые клетки (МСК), выделяемые из костного мозга - одна из наиболее изученных мультипотентных популяций клеток взрослого организма, которая в силу своей относительной доступности к выделению, способности к пролиферации и дифференцировке при культивировании in vitro и при реимплантации, имеет высокую значимость в клинической практике.
Среди большого количества протоколов дифференцировки МСК в различных направлениях, характеризующихся различными индукторами и их концентрациями, необходимо определить оптимальные - пригодные для использования в практической медицине.
Цель- научное обоснование и оптимизация протоколов дифференцировки мезенхимальных стволовых клеток в клетки костной и хрящевой ткани для использования в клинической практике.
Сущность достижения - отработаны оптимальные протоколы дифференцировки МСК в остео- и хондрогенном направлении и определены сроки их преддифференцировки in vitro для дальнейшего применения клеток в регенеративной медицине.
МСК получали из костного мозга человека и наращивали in vitro в присутствии АВ-сыворотки (IV) человека (производство РНПЦ трансфузиологии и медицинских биотехнологий) до необходимых объемов. Для дифференцировки МСК в различных направлениях использовали клетки 2 и 3-го пассажей.
Нами апробированы два протокола остеогенной дифференцировки. В первом случае концентрация дексаметазона составляет 100 нМ, L-аскорбиновой кислоты - 50 мкг/мл, β-глицерол-2-фосфата - 10 мМ. Во втором случае в дифференцировочную среду вносили костный морфогенетический белок 2 типа (BMP2). Остеогенная дифференцировка подтверждена образованием оссификатов и фосфатов кальция при окраске ализариновым красным и нитратом серебра (по Коссу), синтезом щелочной фосфатазы и экспрессией молекулярно-генетических маркеров остеогенной дифференцировки. Результаты увеличения экспрессии маркерных генов в результате остеогенной дифференцировки представлены в таблице.
Таблица - Уровень экспрессии маркерных генов
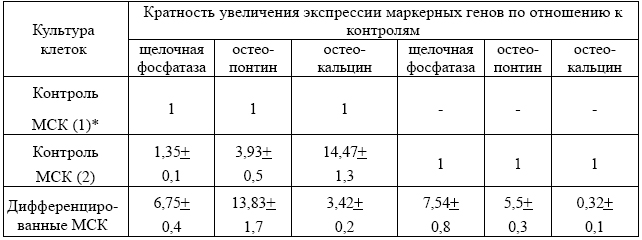
Добавление ВМР-2 в дифференцировочную среду усиливает экспрессию остеопонтина и остеокальцина.
Установлено, что для использования МСК в целях регенеративной медицины целесообразно наращивать биомассу и производить направленную остеогенную дифференцировку в течение не более 7 дней. При более длительном сроке дифференцировки образуются плотные межклеточные взаимодействия МСК и участки минерализации, которые затрудняют снятие клеток с поверхности флакона.
При сравнительном анализе протоколов хондрогенной дифференцировки отмечены различные подходы. Показано, что основные дифференцировочные факторы - трансформирующий фактор роста (TGF-β1, TGF-β3) и костный морфогенетический белок (BMP-2, 4, 6) используются как отдельно, так и в сочетании. При этом концентрация TGF составляет 10 нг/мл, а BMP - 100 нг/мл.
При сравнении хондрогенного потенциала двух типов - МСК костного мозга и хрящевой ткани - показано, что последние под влиянием TGF-β1 и его комбинации с ВMP-2 продуцируют более высокий уровень гликозаминогликанов и специфических молекулярно-генетических маркеров (коллаген II, IX и аггрекан) на 7-е сут культивирования.
Оценивали влияние 3D концентрации фибринового геля на хондрогенную дифференцировку МСК костного мозга человека in vitro. Установлено, что в фибриновом геле с содержанием фибриногена 8 мг/мл в большей степени по сравнению с уровнем 4 мг/мл при культивировании в хондрогенной среде усиливается хондрогенная дифференцировка МСК костного мозга человека in vitro.
Полученные результаты свидетельствуют о том, что МСК хрящевой ткани обладают более высоким хондрогенным потенциалом по сравнению с МСК костного мозга. Но учитывая малодоступность, низкую пролиферативную активность, низкую клеточность и длительное время культивирования такой материал не обладает преимуществами для использования в клеточных технологиях регенеративной медицины. Для клинических целей целесообразно культивирование МСК в монослое с преддифференцировкой в течение 7 дней в присутствии TGF-β3. Результаты свидетельствуют также о возможности применения фибринового геля в тканевой инженерии хряща в качестве матрицы-носителя для доставки индуцированных МСК костного мозга человека в хондрогенном направлении.
По результатам исследования разработаны лабораторные регламенты получения дифференцированных в остео- и хондрогенном направлении МСК человека с целью использования их в регенеративной медицине.
Область применения: травматология, хирургия, регенеративная медицина, клеточные биотехнологии.
Рекомендации по использованию: рекомендуется для клинического использования мезенхимальных стволовых клеток, преддифференцированных в остео- и хондрогенном направлении (травматология, хирургия).
Предложения по сотрудничеству: совместные исследования для изучения потенциала мезенхимальных стволовых клеток, использования их в клинике, разработке новых протоколов лечения.