УДК: 615.012:577.175.446]-097
Год издания: 2016
Получение вариантов рекомбинантного прокальцитонина человека и изучение их иммуногенных свойств
Акалович С.Т., Квач С.В., Рымко А.Н., Радевич Д.С., Зинченко А.И., Пашкова О.Л., Дорошенко Т.М.
Рубрики: 62.13.39, 62.41.31, 76.35.33
Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий
Тема НИР: «Разработка технологии и освоение производства набора реагентов для количественного определения прокальцитонина в биологических жидкостях человека».
Сроки выполнения НИР: 2014—2017 гг.
Научный руководитель: канд. биол. наук Т.М. Дорошенко, канд. биол. наук С.В. Квач.
Соисполнители: ГНУ «Институт микробиологии Национальной академии наук Беларуси»
Источник финансирования: госбюджет.
Цель - осуществить сборку гена прокальцитонина (ПКТ) методом перекрывающейся полимеразной цепной реакции (ПЦР), получить штаммы-продуценты рекомбинантного ПКТ, наработать, очистить и охарактеризовать полученные варианты ПКТ, проиммунизировать лабораторных животных и оценить эффективность разработанных схем иммунизации.
Несмотря на значительный прогресс в медицине по-прежнему наблюдается рост числа тяжелых инфекционных заболеваний с сохранением высокой летальности даже в развитых странах. Сепсис - одна из наиболее частых причин смертности в США: около 100 случаев на 100 000 населения с ежегодным приростом 8,7%. Смертность при сепсисе составляет, по разным источникам, от 30 до 60%, а затраты на каждого пациента достигают 22 000 долларов. Успех терапии напрямую зависит от ранней диагностики и своевременного начала лечения.
Прокальцитонин - это предшественник гормона кальцитонина, состоящий из 116 аминокислот. При наличии инфекции и/или развитии сепсиса провоспалительные цитокины и бактериальные липополисахариды индуцируют образование прокальцитонина не только в специализированных С-клетках щитовидной железы, где он продуцируется в норме, но и паренхимальных клетках печени, почек, легких, мышечной ткани, в адипоцитах, которые в отличие от С-клеток не имеют специфических ферментов для расщепления ПКТ, что приводит к повышению его концентрации в крови. Показано, что у пациентов с вирусной инфекцией или воспалительными заболеваниями содержание маркера остается постоянно низким, что делает целесообразным определение ПКТ для диагностики и прогноза течения бактериальной инфекции. При целом ряде воспалительных заболеваний небактериальной этиологии значения ПКТ остаются все время низкими в отличие от других маркеров воспаления (скорость оседания эритроцитов, концентрация С-реактивного белка, интерлейкина-6). Повышение уровня ПКТ происходит только в случае присоединения бактериальной инфекции, что позволяет дифференцировать обострение основного заболевания и наличие инфекции.
В США количественное определение уровня ПКТ предложено в качестве основного теста при принятии решения о назначении и/или отмене антибиотиков у пациентов с сепсисом или инфекциями дыхательных путей. При использовании алгоритмов, основанных на определении уровня ПКТ, было отмечено сокращение частоты назначения антибиотиков (на 11-74% по данным разных исследований), а также уменьшение продолжительности их применения (на 15-55%). При этом не выявлено ухудшения исходов лечения в исследуемой группе относительно группы сравнения: общая частота летальных исходов составила 7,7 и 8,3% соответственно. Очень важно проводить диагностику бактериальных инфекций и мониторинг антибиотикотерапии, имея надежный тест для количественного определения ПКТ. Наиболее чувствительным, специфичным и доступным методом определения белков острой фазы, цитокинов и других диагностически значимых факторов стал метод иммуноферментного анализа (ИФА) с использованием антител.
Разработка отечественного теста для количественного определения прокальцитонина методом ИФА неразрывно связана с получением рекомбинантного ПКТ человека, пригодного для иммунизации животных, что является целью настоящей работы.
Методы исследования. В качестве матрицы для дизайна олигонуклеотидов для синтеза гена была использована аминокислотная последовательность препрокальцитонина (genbank, GI:4502545). Поскольку кодонный состав человека и Esherichia coli существенно различается, была проведена оптимизация кодонной последовательности для экспрессии целевого белка в E. coli. Для оптимизации использовали программное обеспечение Genedesign (DNA2.0, США). Ген собирали из олигонуклеотидов методом перекрывающейся ПЦР. Олигонуклеотиды подбирали с применением программного TmPrime (
Полученный в результате сборки линейный фрагмент с размером 360 п.о., содержащий на 5‘- и 3‘-концах сайты узнавания рестрикционных эндонуклеаз BamH I и Xho I, обрабатывали соответствующими эндонуклеазами рестрикции и клонировали в составе вектора pET 28a (Novagen, США) в клетках E. coli BL21(DE3) с получением штамма E. coli PKT1, продуцирующего белок fusion 1. Данный белок идентичен по аминокислотной последовательности нативному ПКТ и дополнительно содержит остатки из 6 гистидинов как на С, так и N-конце. Переклонирование гена ПКТ, обеспечивающего экспрессию прокальцитонина с нативными N- и С-концами, проводили в вектор pTXB1 с применением перекрывающейся продолженной полимеразной цепной реакции. Данная конструкция позволяет получать белок, который после очистки на хитин-связывающей сефарозе может подвергаться аутопротеолизу при наличии в среде 1 М ДДТ, с получением молекулы с нативными C- и N-концами.
Клетки E. coli выращивали на термостатированных биологических качалках с частотой колебания платформы 170-190 об/мин при +25° С на среде (0,5 л) следующего состава: триптон - 1%, дрожжевой экстракт - 0,5%, глюкоза - 0,5%, NaCl - 1%. В среду дополнительно вносили канамицин до 50 мкг/мл. Клетки выращивали до оптической плотности 1,5 (λ=600 нм), затем проводили индукцию синтеза белка путем внесения изопропил-β-D-тиогалактопиранозида (ИПТГ) до концентрации 0,1 ммоль, продолжая культивирование в течение 4 ч. По окончании культивирования клетки осаждали центрифугированием в течение 10 мин при 5000хg. Осадок клеток ресуспендировали в 50 мл лизирующего буфера, содержащего 50 ммоль NaH2P04, 400 ммоль NaCl и 20 ммоль имидазола (рН 8,0). Ультразвуковую дезинтеграцию клеток осуществляли на приборе Branson Sonifier 450 при мощности 40-50 Вт (360 импульсов по 0,5 с).
После центрифугирования образца при 20000хg в течение 30 мин супернатант наносили на хроматографическую колонку (l=48 мм, d=20 мм) с 4 мл смолы Profinity IMAC («Biorad», США). Колонку промывали 10 объемами лизирующего буфера. Белок элюировали 3 объемами буфера, содержащего 50 ммоль NaH2PО4, 400 ммоль NaCl и 500 ммоль имидазола (рН 8,0). Раствор белка подвергали диализу против 1000-кратного объема буфера следующего состава: KH2PO4 - 1,7 ммоль, Na2HPO4 - 5,2 ммоль, NaCl - 150 ммоль, pH 7,4 и стерилизовали фильтрованием.
Иммуноферментный анализ проводили с иммобилизованным на твердой фазе антигеном с последующей инкубацией с первичными специфическими антителами и вторичными антивидовыми антителами, конъюгированными с пероксидазой хрена.
Результаты исследований. Собран ген, кодирующий прокальцитонин человека. Полученный ген клонирован в составе вектора pET28a+ в клетках E. coli BL21 (DE3).
Оптимизированы условия экспрессии целевого белка в созданном штамме-продуценте: внесение индуктора (ИПТГ) при достижении клетками оптической плотности 1,5 (λ=600 нм), температура культивирования - 30°C, длительность индукции - 4 ч после внесения индуктора, концентрация индуктора - 0,1 ммоль. Подобранные условия экспрессии рекомбинантного модифицированного ПКТ (fusion 1) позволили увеличить выход белка с 1 л культуры в 1,5 раза с 16 до 24 мг белка.
Разработана схема очистки белка fusion 1 с использованием одноэтапной металлоаффинной хроматографии.
Наработан рекомбинантный модифицированный ПКТ fusion 1 в количестве 7 мг с чистотой более 90% и выходом целевого белка 60%.
Переклонирование гена ПКТ, обеспечивающего экспрессию прокальцитонина с нативными N- и С-концами, проводили в вектор pTXB1 с применением перекрывающейся продолженной полимеразной цепной реакции. В результате ген ПКТ был слит с интейном, содержащим хитин-связывающий домен. Данная конструкция позволяет получать белок, названный fusion 2, который после очистки на хитин-связывающей сефарозе может подвергаться аутопротеолизу при наличии в среде 1 М ДТТ с получением молекулы с нативными C- и N-концами. Наработан рекомбинантный нативный ПКТ в количестве 1 мг.
Антигенные свойства полученного белка fusion 1 проанализированы методом ИФА с помощью кроличьих поликлональных антител, специфичных к ПКТ человека («Daco») (рис. 1). Рекомбинантный белок fusion 1 не отличался от рекомбинантного ПКТ («Shenandoah Biotechnology», США) по способности связываться со специфическими антителами в ИФА.
Для оценки иммуногенных свойств полученных белков ПКТ проведена иммунизация мышей линии BALB/с в присутствии полного или неполного адъюванта Фрейнда при первой и последующих иммунизациях соответственно. Забор крови для исследования проводили из хвостовой вены на 10-е сут после иммунизации. Специфические антитела в плазме крови иммунизированного животного определяли методом ИФА. Установлено, что все мыши, иммунизированные нативным рекомбинантным ПКТ, погибали после 2-3 иммунизации, что возможно, связано с высокой гомологией (77%) молекул ПКТ мыши и человека, а также выявлено пролонгированное с помощью адъювантов действие ПКТ. В то же время рекомбинантный белок fusion 1 способен индуцировать образование специфических антител, титр которых растет с увеличением количества иммунизаций (рис. 2), и не приводит к гибели животных. Важно отметить, что при иммунизации рекомбинантным модифицированным белком fusion 1 около 60-70% специфических антител наряду с использованным нами иммуногеном распознавали и рекомбинантный ПКТ человека.
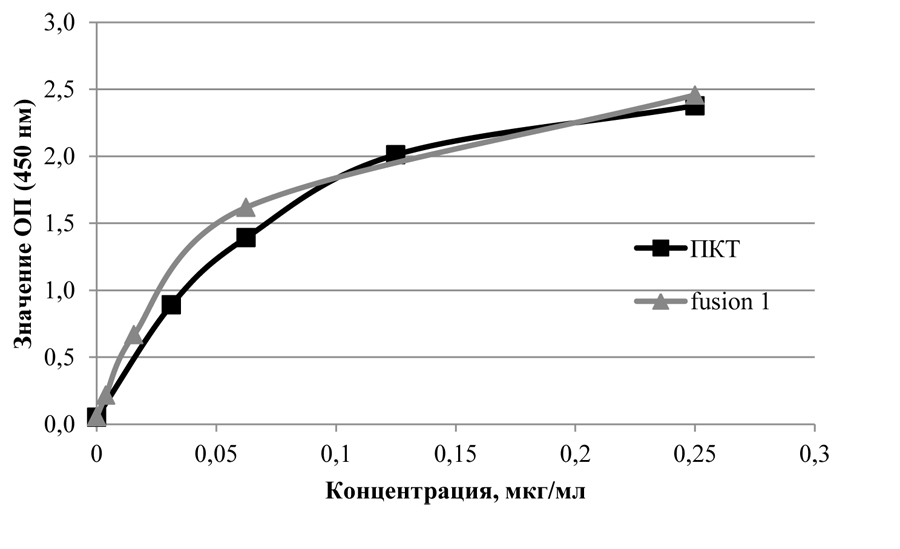
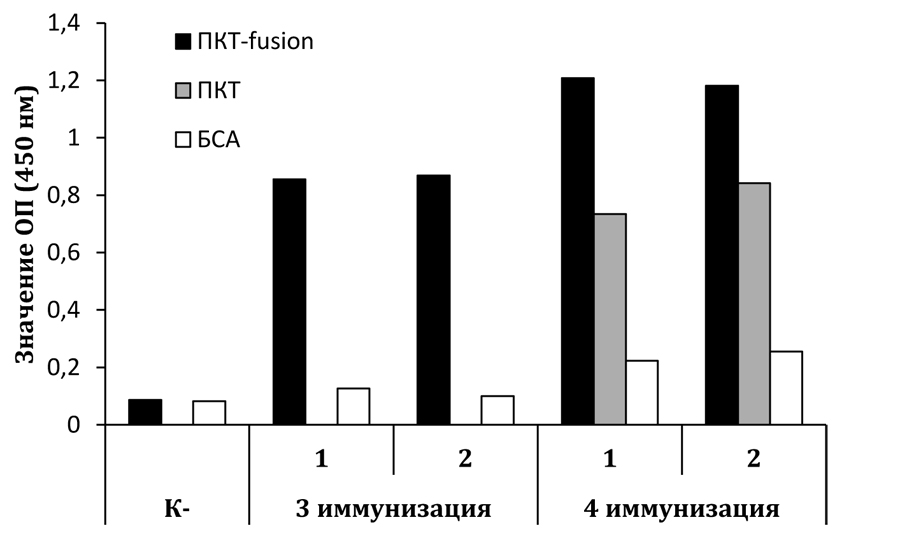
Представлены средние значения оптической плотности дуплета, полученные в ИФА с иммобилизованным на твердой фазе ПКТ, fusion 1 и БСА (бычьим сывороточным альбумином) в концентрации 0,25 мкг/мл и плазмой крови мыши (номер 1, 2) в разведении 1:500. К- - плазма крови контрольной неиммунизированной мыши.
Таким образом, показано, что для формирования иммунного ответа на ПКТ и получения высоких титров специфических антител необходимо использовать модифицированную молекулу ПКТ, чтобы увеличить ее чужеродность для мыши и усилить антигенные свойства. Создан штамм-продуцент, экспрессирующий рекомбинантный модифицированный прокальцитонин человека. Наработан препарат белка fusion 1 (чистота более 90%), который по антигенным свойствам не отличается от коммерчески доступного рекомбинантного ПКТ и обладает достаточной иммуногенностью, чтобы быть использованным для иммунизации животных с целью получения специфических антител.
Вид патентной защиты: отсутствует, планируется подача заявки.
Область применения: лабораторная диагностика.
Рекомендации по использованию: рекомендуется использовать для создания отечественной диагностической иммуноферментной тест-системы для количественного определения уровня прокальцитонина в биологических жидкостях человека.
Предложения по сотрудничеству: совместные исследования по указанной тематике.