УДК: 616.411-006.441-036.86-07:577.21
Год издания: 2016
Определение минимальной диссеминированной и минимальной остаточной болезни методом полимеразной цепной реакции в реальном времени с использованием пациент-специфических праймеров при лимфоме/лейкозе Беркитта с наличием перестройки MYC-IgH
Федорова А.С., Лавриненко В.А., Мелешко А.Н., Алейникова О.В.
Рубрики: 76.29.47, 76.29.49, 76.35.33
Республиканский научно-практический центр детской онкологии гематологии и иммунологии
Тема НИР: «Разработать и внедрить комплексный метод диагностики и оценки минимальной диссеминированной и минимальной остаточной болезни при неходжкинских лимфомах у детей».
Сроки выполнения НИР: январь 2011 г. — декабрь 2015 г.
Научный руководитель: д-р мед. наук, проф., чл.-кор. НАН Беларуси О.В. Алейникова.
Источник финансирования: госбюджет, ГНТП «Новые технологии диагностики, лечения и профилактики», подпрограмма «Онкология».
При лимфоме/лейкозе Беркитта примерно в 75% случаев выявляется транслокация t(8;14)(q24;q32) и специфическая перестройка MYC-IgH, которая может служить мишенью для оценки минимальной диссеминированной (МДБ) и минимальной остаточной болезни (МОБ). Данные литературы относительно прогностического значения МДБ и МОБ при этой патологии противоречивы. В данной работе мы количественно определяли МДБ и МОБ у пациентов с перестройкой MYC-IgH с целью сравнения нового, разработанного нами метода с уже используемыми, а также оценки возможного прогностическое значение МОБ при лимфоме/лейкозе Беркитта.
Обследованы 12 первичных пациентов с диагнозом лимфома Беркитта (группа высокого риска) или лейкоз Беркитта с перестройкой MYC-IgH, установленным в ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии» в 2009-2014 гг. на основании морфологических и иммунологических критериев классификации Всемирной организации здравоохранения. Стадирование проводилось в соответствии с классификацией S.B. Murphy. У 4 пациентов была III стадия, у 3 - IV стадия, у 5 - лейкоз. Все пациенты получили лечение по протоколу В-НХЛ 2004/2010М, 3 умерли и 9 живы. Время наблюдения за последним пациентом, включенным в исследование, составило 12 мес.
Диагностический опухолевый материал, а также костный мозг (КМ) и периферическая кровь (ПК), забранные до начала лечения, исследовались с помощью полимеразной цепной реакции (ПЦР) длинных фрагментов (ПЦР-ДФ) на наличие перестройки MYC-IgH. Для отработки и оптимизации метода ПЦР-ДФ была использована клеточная линия Raji с транслокацией t(8;14)(q24;q32). Затем участок слияния MYC-IgH секвенировали и подбирали праймеры для каждого пациента. Уровень МДБ и МОБ определяли количественно методом ПЦР в реальном времени с использованием пациент-специфических праймеров (ПС-ПЦР) в КМ и/или ПК до начала лечения, после профазы и перед последующими блоками полихимиотерапии (ПХТ). Чувствительность метода составила 10-5-10-6. Данный метод разработан авторами статьи и запатентован (патент BY 20153 C1 2016.06.30). Параллельно у 7 пациентов определяли МДБ/МОБ методом ПС-ПЦР по клональным реаранжировкам гена IgH, выявленным в результате ПЦР-скрининга. Чувствительность метода составила 10-4-10-5.
Статистическая обработка полученных данных проводилась с использованием программ Microsoft Excel 2000 и Statistica 6.0. Проверка гипотез о равенстве двух средних производилась с помощью критерия U-теста Манна-Уитни для количественных признаков. Корреляционный вариационных рядов проводили по методу Спирмена с обязательным расчётом достоверности корреляционной связи. При оценке достоверности различий или корреляционных связей использовали порог значений р < 0,05.
Выявление МДБ в КМ и/или ПК методом ПС-ПЦР до начала лечения имело место у всех пациентов с лимфомой Беркитта без морфологических признаков поражения КМ (у 2 пациентов с III стадией, у 3 - с IV). При анализе МОБ положительный результат получен после профазы у 6 из 9 (66,6%) обследованных, перед 2-м блоком химиотерапии - у 2 из 11 (18,2%). Таким образом, 10 (83,3%) пациентов стали МОБ-негативными после первого блока ПХТ. Двое пациентов (у 1 - III стадия, у 1 - лейкоз) оставались МОБ-позитивными на протяжении всего лечения. У обоих пациентов (только у них) в дальнейшем развился рецидив, что может свидетельствовать о неблагоприятном значении наличия МОБ перед 2-м блоком полихимиотерапии в плане высокого возврата заболевания (p=0,015).
Было проведено сопоставление методов ПЦР-ДФ и ПС-ПЦР для анализа МОБ. В таблице 1 представлены результаты анализа МОБ в КМ и ПК у пациентов с лейкозом Беркитта. У всех обследованных перед 2-м блоком была достигнута морфологическая ремиссия. С помощью ПЦР-ДФ качественно у всех пациентов перед 2-м блоком ПХТ МОБ не выявлена. Метод определения реаранжировки MYC-IgH с использованием пациент-специфических праймеров показал наибольшую чувствительность среди сравниваемых методов. У пациента №1 развился рецидив через 1 мес. после окончания лечения. Выявленная только этим методом МОБ оставалась положительной во всех исследованных на лечении точках. С помощью определения клональных реаранжировок IgH у пациента №4 перед 4-м и после 4-го блока был получен ложноположительный результат за счет детекции поликлональных фоновых реаранжировок, так как он находится в полной продолжающейся первой ремиссии (время наблюдения - 25 мес.).
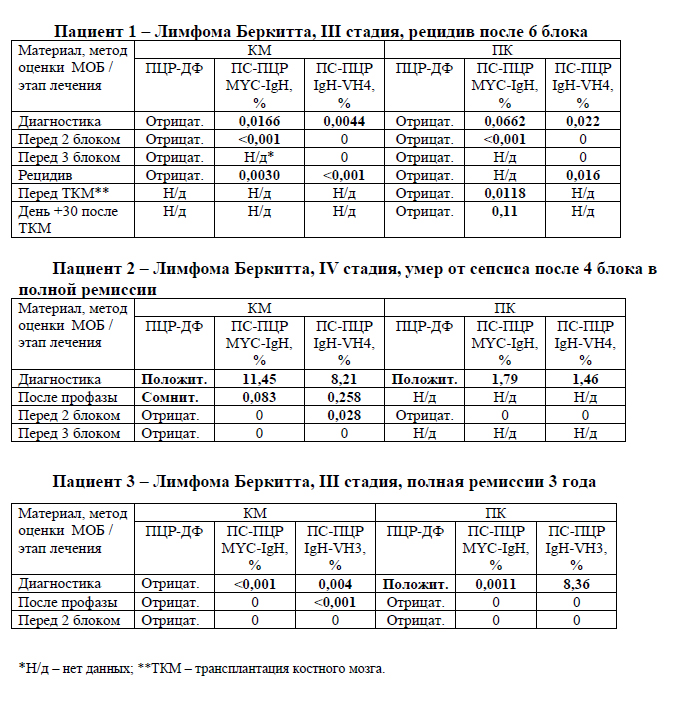
Результаты анализа МОБ в КМ и ПК у пациентов с лимфомой Беркитта представлены в таблице 2. Методом ПЦР-ДФ лимфомные клетки не выявлялась ни в КМ, ни в ПК у двоих пациентов без морфологических признаков поражения КМ, в то время как более чувствительным методом ПС-ПЦР МДБ определялась у всех пациентов. У пациента №2 развился ранний рецидив через 1 мес. после последнего курса полихимиотерапии. Перед 2-м блоком методом определения реаранжировки MYC-IgH с использованием пациент-специфических праймеров он оставался МОБ-позитивным.
В большинстве случаев нами получены конкордантные результаты при мониторинге МОБ методами количественного определения реаранжировки MYC-H и клональных реаранжировок генов IgH (r = 0,86). Чувствительность метода определения клональных реаранжировок Ig ограничена детекцией фоновых поликлональных реаранжировок на уровне 10-4-10-5. Уровень МОБ в КМ и в ПК во всех результативных случаях был сопоставим, в связи с чем ПК может быть рекомендована в качестве материала для анализа МОБ у пациентов с лимфомой/лейкозом Беркитта.
Таким образом, разработанный нами способ количественного мониторинга МОБ в ПК при лимфоме/лейкозе Беркитта методом ПС-ПЦР с использованием пациент-специфических праймеров для реаранжировки MYC-IgH в силу высокой чувствительности (10-5-10-6) и возможности использования ДНК любого качества является оптимальным и может быть рекомендован для анализа МОБ при лимфоме/лейкозе Беркитта с транслокацией t(8;14)(q24;q32). При отсутствии MYC-IgH методом выбора является ПС-ПЦР для определения клональных реаранжировок Ig. Наличие МОБ перед 2-м блоком полихимиотерапии является неблагоприятным фактором в плане высокого риска развития рецидива.
Таблица 1 - Сравнение результатов МОБ в КМ и ПК методами ПЦР-ДФ и ПС-ПЦР для выявления реаранжировки MYC-IgH и клональных реаранжировок IgH у пациентов с лейкозом Беркитта
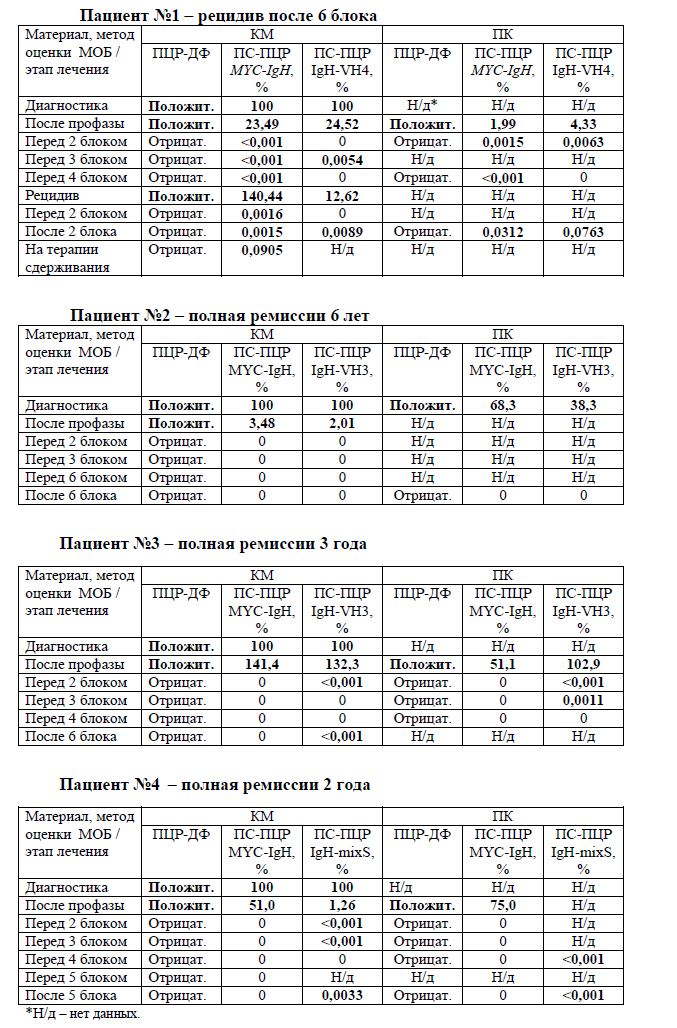
Таблица 2 - Сравнение результатов МОБ в КМ и ПК методами ПЦР-ДФ и ПС-ПЦР для выявления реаранжировки MYC-IgH и клональных реаранжировок IgH у пациентов с лимфомой Беркитта высокого риска
Вид патентной защиты: Патент BY 20153 C1 2016.06.30. В.А. Лавриненко, Т.В. Савицкая, А.С. Федорова, О.В. Алейникова. Способ определения нормализованного уровня экспрессии химерного гена MYC-IgH для молекулярно-генетической диагностики минимальной остаточной болезни при лимфоме Беркитта или зрелом В-остром лимфобластном лейкозе.
Патентообладатель: ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии» Минздрава Республики Беларусь
Область применения: медицина
Рекомендации по использованию: способ определения нормализованного уровня экспрессии химерного гена MYC-IgH для молекулярно-генетической диагностики минимальной остаточной болезни при лимфоме Беркитта или зрелом В-остром лимфобластном лейкозе — внедрен в ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии».