УДК: 616.12-007-053.1-089.5:616.24-085.816]-089.168.1
Год издания: 2016
Влияние схемы анестезиологического пособия на продолжительность послеоперационной искусственной вентиляции легких
Замареев А.И., Лесковский Д.В., Шалькевич А.Л., Фурманчук Д.А., Князев А.Н.
Рубрики: 76.29.39, 76.29.44
Республиканский научно-практический центр детской хирургии
Тема НИР: «Разработать и внедрить метод протективной респираторной поддержки в раннем послеоперационном периоде у детей с врожденными пороками сердца».
Сроки выполнения НИР: январь 2015 г. — январь 2017 г.
Научный руководитель: канд. мед. наук Д.А. Фурманчук.
Источник финансирования: госбюджет.
Долгое время существовало мнение, что массивная хирургическая травма, выраженная фармакологическая агрессия (анестезиологическое пособие) в сочетании c новыми анатомическими условиями функционирования миокарда у пациентов с врожденными пороками сердца (ВПС) обязательно сопровождается необходимостью пролонгированной послеоперационной искусственной вентиляции легких (ИВЛ). Ранний период после операций по коррекции ВПС часто протекает на фоне адаптации сердца к новым анатомическим условиям и также требует от врача интенсивной терапии обеспечения констант газообмена, метаболизма, мониторинга и коррекции гемодинамической нестабильности на фоне адекватного предотвращения болевой стимуляции. Адекватное лечение боли в раннем периоде после операции является непростой задачей по целому ряду причин. Традиционно использование наркотических анальгетиков в течение первых суток и нередко до удаления дренажных трубок. Фентанил либо морфин в дозировках, достаточных для полного блокирования болевой стимуляции, оказывает подавляющее действие на дыхательный центр и пролонгирует ИВЛ, кроме того, влияет на сосудистый тонус, вызывая гипотензию. Искусственная вентиляция легких обеспечивает управляемый газообмен, сокращает метаболические потребности, снижая нагрузку на дыхательную мускулатуру, создает условия для максимально эффективного обезболивания. Ряд работ свидетельствует о негативном влиянии длительной ИВЛ, также как и продолжительного пребывания в отделении интенсивной терапии как на исход заболевания в раннем и отдаленном периоде, так и на фармакоэкономическую составляющую процесса лечения ВПС. Одновременно существует мнение, что ранняя экстубация и перевод на спонтанное дыхание потенциально не вполне безопасны ввиду ожидаемого дополнительного стресс-ответа, связанного с физической перегрузкой дыхательной мускулатуры в условиях транзиторной миокардиальной дисфункции, наличия остаточной седации и угнетения самостоятельного дыхания.
Выбор доз препаратов для обезболивания, способа их введения (внутривенной постоянной инфузии с постоянной скоростью поступления 10-30 мкг/кг/ч либо минимальных дискретных доз, составляющих 2-5 мкг/кг/ч в течение всего интраоперационного периода, вводимых струйно по потребности с интервалом 1-2 раза/ч), также как и оптимального режима введения миорелаксантов по-прежнему является предметом дискуссии. Очевидно, что две перечисленные составляющие анестезиологического пособия не могут не влиять на течение послеоперационного периода.
Теоретическое обоснование интраоперационного использования высоких доз фентанила (от 10 до 30 мкг/кг/ч) вполне убедительно и доказательно с точки зрения предотвращения гормонального и метаболического стресс-ответа и осуществления нейровегетативной защиты, в т.ч. предусматривающей перевод на спонтанное дыхание в максимально «надежных» с точки зрения физиологической нормы показателях газообмена, температуры, кровообращения и дыхания.
C другой стороны, имеется не меньше исследований, доказывающих целесообразность использования минимально возможных доз наркотических анальгетиков и препаратов для выключения сознания, направленных на максимально быстрое отлучение от респираторной поддержки, обосновывающих эту стратегию, с точки зрения как фармакоэкономики, так и физиологии кровообращения и дыхания, подтверждающих незначительное влияние этого компонента нейровегетативной защиты на выраженность послеоперационного стресс-ответа, и одновременно рекомендующих назначение нестероидных противовоспалительных средств в схеме интраоперационной анальгезии.
Кроме того, по мере расширения спектра оперируемых пороков все большее значение приобретает приоритет гемодинамической стабильности в ходе подготовки пациента к основному этапу операции и после отлучения от искусственного кровообращения. В этом контексте использование больших доз фентанила потенциально небезопасно в отношении развития гипотензии и дефицита периферической перфузии.
Несмотря на продолжительную дискуссию (исследования датируются как 80 гг. XX в., так и вторым 10-летием ХXI в.), в настоящее время в анестезиологической практике отсутствует единый подход, описывающий наиболее оптимальное ведение анестезиологического пособия раннего послеоперационного периода у пациентов после хирургической коррекции ВПС. Разработка такого подхода позволит ответить на ряд практических вопросов, сформулированных выше.
Цель - изучение возможности сокращения продолжительности послеоперационной искусственной вентиляции легких у детей после хирургической коррекции врожденных пороков сердца путем влияния на режим введения наркотических анальгетиков и мышечных релаксантов, а также выявление факторов, пролонгирующих искусственную вентиляцию в послеоперационном периоде.
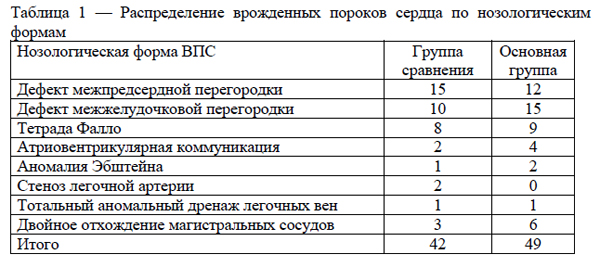
Исследовано течение периоперационного периода у 91 пациента, получавшего хирургическое лечение в ГУ «РНПЦ детской хирургии» по поводу врожденных пороков сердца. Распределение по нозологическим формам врожденных пороков сердца отражено в таблице 1. Основную исследуемую группу составили 49 пациентов (24 мальчика и 25 девочек), в группу сравнения вошли 42 пациента (20 мальчиков и 42 девочки). В исследование включены дети в возрасте от 6 мес. до 10 лет (медиана возраста 4,5 года). Всем пациентам выполнялась хирургическая коррекция ВПС с искусственным кровообращением на фоне общей комбинированной эндотрахеальной анестезии.
Пациентам основной исследуемой группы в схеме анестезиологического пособия осуществлялось фракционное введение фентанила в дозе 2-3 мкг/кг каждые 20-30 мин, рокуроний использовался только в предперфузионном периоде. Пациентам группы сравнения фентанил вводился путем непрерывной инфузии в дозе 10 мкг/кг/ч, миорелаксанты - в соответствии с инструкцией по использованию (рокуроний каждые 40 мин 0,15-0,2 мг/кг).
Всем пациентам выполнялась стандартная премедикация, включающая использование атропина в дозе 0,1 мг/кг и мидазолама 0,5 мг/кг внутрь либо внутримышечно за 30 мин до подачи в операционную. Индукция в анестезию обеспечивалась ингаляцией севофлюрана в кислородно-воздушной смеси. Доза севофлюрана в объемных процентах (%) во время выполнения индукции в анестезию определялась ответом на ингаляционное введение, состоянием показателей кровообращения во время индукции и варьировала в пределах от 3,5 до 6,5. По мере наступления очевидного выключения сознания выполнялась пункция и катетеризация периферической вены. Ввиду того, что у всех без исключения пациентов признаков ожидаемой трудной интубации не обнаруживалось, препаратом для стартового обеспечения мышечной релаксации служил рокуроний в дозе 0,6 мг/кг, который вводился после обеспечения надежного периферического сосудистого доступа. Обезболивание интубации трахеи осуществлялось введением 2 мг/кг фентанила в основной группе и 5 мг/кг фентанила в группе сравнения. После интубации трахеи и настройки параметров искусственной вентиляции легких осуществлялась катетеризация артерии и центральной вены, налаживался инвазивный мониторинг артериального и центрального венозного давления. В основной исследуемой группе пациентам выполнялось фракционное введение фентанила в дозировке 2-3 мкг/кг с кратностью введения каждые 30 мин. Кратность введения увеличивалась в случае обнаружения минимальных признаков наличия болевой чувствительности (тенденция к повышению артериального давления, частоты сердечных сокращений). Одновременно не менее одного, но в большинстве случаев два раза в предперфузионном периоде выполнялся контроль газов крови, электролитов и гликемии артериальной крови. Обнаружение тенденции к гипергликемии рассматривалось как косвенный признак наличия боли и повод для внеочередного введения фентанила. Выключение сознания обеспечивалось подачей в дыхательный контур севофлюрана в дозе 1,8-2,5 объемных % до и после искусственного кровообращения (ИК). Во время искусственного кровообращения выключение сознания обеспечивалось фракционным введением мидазолама в дозе 0,3 мг/кг в контур аппарата ИК. Мышечная релаксация достигалась фракционным введением рокурония в дозе 0,1 мг/кг каждые 30 мин.
После завершения периода ИК и возобновления ИВЛ в дыхательный контур вновь начинали подавать севофлюран в дозе, соответствующей минимальной альвеолярной концентрации анестетика. Обезболивание обеспечивалось назначением фентанила, мышечная релаксация - рокурония. При необходимости в зависимости от продолжительности ИК, длительности периода ишемии миокарда, температуры тела пациента во время ИК, состоятельности в отношении обеспечения перфузии назначались препараты инотропного (адреналин, допамин), вазопрессорного (норадреналин, фенилэфрин), люзитропного (милринон) действия под контролем мониторинга центральной гемодинамики. Для коррекции кислородной емкости крови и гемостаза при необходимости выполнялись трансфузии эритроцитарной массы, свежезамороженной плазмы, концентрата тромбоцитов в соответствии с групповой совместимостью и объемно-скоростными характеристиками, соответствующими текущей гемодинамической ситуации. После завершения операции пациенту прекращали введение препаратов наркотического и миорелаксирующего действия, на фоне ИВЛ транспортным аппаратом ИВЛ выполнялась транспортировка в палату интенсивной терапии. В палате интенсивной терапии в зависимости от гемодинамической стабильности, текущих терапевтических цен назначались различные обезболивающие средства для обеспечения медикаментозного сна. При гемодинамической стабильности, нормальных (либо приемлемых с точки зрения этапа коррекции ВПС) показателях газов крови, электролитов, восстановлении спонтанной инспираторной активности, переходили на вспомогательный режим ИВЛ. При отсутствии признаков гемодинамической нестабильности, кровотечения, наличии толерантности к снижению давления поддержки, плавного восстановления сознания, стабильного возрастного либо нарастающего дыхательного объема переходили на спонтанное дыхание с последующей экстубацией. После экстубации большинство пациентов получало кислород через назальные канюли. Состоятельность самостоятельного дыхания контролировали определением газов крови, кислотно-основного статуса и электролитов.
У пациентов основной группы продолжительность послеоперационной ИВЛ составила 2,9±1,1 ч, в контрольной группе этот показатель был равен 9,86±5,65 ч. Ввиду ненормальности распределения вариант в обоих вариационных рядах показателя продолжительности послеоперационной искусственной вентиляции легких сравнение выполнялось по критерию Mann-WhitneyU; показана достоверная статистическая разница с p<0,05 в группах в отношении продолжительности ИВЛ.
Влияние режима введения и дозировки фентанила, режима использования мышечных релаксантов, степень выраженности метаболического ацидоза, уровень лактата в артериальной крови, скорость диуреза в течение первых 2 ч после завершения ИК на продолжительность послеоперационной ИВЛ оценивали методом множественной регрессии. Выявлено, что постоянная инфузия фентанила по сравнению с болюсными введениями, использование мышечных релаксантов после завершения ИК, лактатацидемия (более 4 ммол/л), метаболический ацидоз (с дефицитом оснований более 8 ммол/л) более 1 ч после завершения искусственного кровообращения достоверно пролонгировали продолжительность послеоперационной ИВЛ (p<0,05). С учетом малого числа случаев с использованием гипотермии во время искусственного кровообращения (4 в основной группе и 6 - в группе сравнения) оценить влияние этого фактора на продолжительность ИВЛ после хирургического вмешательства не удалось.
К факторам, достоверно влияющим на продолжительность ИВЛ и скорость восстановления спонтанной респираторной активности, относят режим введения и дозировка фентанила (p<0,050) и режим введения миорелаксантов (p<0,050). Нарушения периферической перфузии во время ИК, сопровождающиеся увеличением уровня лактата в течение первого часа после ИК свыше 4 ммол/л (p<0,050), дефицита оснований в артериальной крови в течение 1 ч после завершения ИК свыше 8 ммол/л достоверно (p<0,050) пролонгируют период послеоперационной вентиляции. Дополнительного изучения требует влияние ингаляционных анестетиков во время ИК на продолжительность ИВЛ после операции.
Выявлено, что использование схемы с постоянной внутривенной инфузией фентанила в дозе 10 мкг/кг/ч достоверно (p<0,05) пролонгирует продолжительность ИВЛ в послеоперационном периоде по сравнению с болюсными введениями фентанила в дозе 2-3 мкг/кг каждые 20-30 мин. Показано, что введение миорелаксантов в предперфузионном периоде с отказом от их использования в постперфузионном периоде не ухудшает течения анестезиологического пособия, сокращая продолжительность послеоперационной ИВЛ.