УДК: 616-006.6+611.018.1]-076
Год издания: 2016
Микромеханические характеристики раковых клеток
Стародубцева М.Н., Егоренков Н.И., Константинова Е.Э., Мельникова Г.Б., Стародубцев И.Е.
Рубрики: 30.51.43, 34.17.21, 34.19.05, 76.29.49
Гомельский государственный медицинский университет
Тема НИР: «Микромеханические характеристики раковых клеток» (Б14-042, проект БРФФИ).
Сроки выполнения НИР: май 2014 г. — март 2016 г.
Научный руководитель: М.Н. Стародубцева.
Соисполнители: ГНУ «Институт тепло- и массообмена им. А.В. Лыкова НАНБ».
Источник финансирования: госбюджет.
Новым перспективным методом силового зондирования наноиндентором биологических клеток на микро- и наноуровнях является атомно-силовая микроскопия (АСМ), позволяющая определять морфологические (геометрические, структурные) и физико-механические (упругие, фрикционные, адгезионные и др.) свойства, включая их картирование - построение карт распределения их значений [1]. Переход клетки в патологическое состояние сопровождается изменением многих свойств клетки, включая рельеф ее поверхности и физико-механические свойства поверхностного слоя. На основе данных атомно-силовой микроскопии можно оценить набор параметров, характеризующих структурные и механические свойства ее поверхностного слоя, а также геометрические характеристики клеточной поверхности, что открывает новые возможности диагностики на клеточном уровне состояния клетки, установления патологии клетки, включая онкологическую патологию [2-4].
Объектами исследования были клетки карциномы легкого человека (А549), клетки карциномы молочной железы человека (МCF-7), клетки карциномы гортани человека (HEp-2c), клетки асцитной карциномы Эрлиха мыши, мезенхимальные стволовые клетки, первичные и спонтанно иммортализованные фибробласты человека. Препараты клеток, адгезированных к стеклянным пластинам, фиксировали водным раствором глутарового альдегида, отмывали буферно-солевым раствором и дистиллированной водой, высушивали на воздухе при комнатной температуре.
Цель - выявление основных различий микромеханических свойств поверхности (поверхностного слоя) раковых и нераковых клеток и разработка теоретических подходов и практических рекомендаций для диагностики раковых клеток с помощью методов атомно-силовой микроскопии (АСМ) - микроскопии латеральных сил и силовой спектроскопии.
АСМ-исследования проводили на атомно-силовом микроскопе “НТ-206” («МикроТестМашины», Беларусь) на воздухе при комнатных условиях в режимах силовой спектроскопии (оценка параметров упругих и адгезионных свойств: локальный модуль Юнга E и силы адгезии между острием зонда и поверхностью клетки Fа) и в режиме контактного сканирования с использованием термоплатформы ТТ-01 (оценка параметров геометрических и фрикционных свойств: диаметр и высота клеток, параметры распределения сил трения по микромасштабным участкам поверхности клеток). Параметры сил трения (Fтр, σтр) определяли с помощью разработанной нами методики [2,5]. Фрактальную размерность DF топографического изображения поверхности и карт латеральных сил поверхности клеток оценивали методом подсчета кубов. Для этого нами разработан метод оценки фрактальной размерности изображений участков поверхности клеток на основе разбиения участка на фрагменты и анализе статистических параметров набора значений фрактальной размерности для этих фрагментов. Введена новая характеристика DF=φ(t) изображений поверхности клеток, получаемых с помощью атомно-силовой микроскопии, - зависимость фрактальной размерности карт свойств поверхности клеток от коэффициента t масштабирования оси z, которая более полно характеризует особенности поверхности в сравнении со значением фрактальной размерности для единичного значения t, и разработан программный комплекс для ее оценки.
Статистический анализ опытных данных проводили с помощью программ Excel, Statistica (версии 6 и 7), OriginPro 8 SRO. Оценивали нормальность распределения признака методами Колмогорова-Смирнова, Шапиро-Вилк. Выборки, подчиняющиеся нормальному закону распределения, анализировались параметрическими методами. Результаты статистического анализа выражали в виде границ доверительного интервала с доверительной вероятностью 0,95 (95% ДИ). Сравнение выборочных средних проводили с использованием t-критерия Стьюдента с учетом критерия Фишера. При анализе мультимодальных распределений признака проводили аппроксимацию полигона частот кривой, представляющей собой сумму нескольких функций Гаусса. Средние значения признака для каждой субпопуляции выражали в виде математического ожидания (моды) ± 1/2 ширины пика Гаусса, при этом указывали значение коэффициента смешанной корреляции (R2). Сравнение средних выборочных проводили с помощью двустороннего теста различия).
Изучены термомеханические свойства поверхностного слоя раковых и нераковых клеток (значения сил трения скольжения и распределение их на поверхности клетки) в широком интервале температур (15-90 оС). Показано, что характер их температурных зависимостей близок и аналогичен характеру температурных зависимостей этих свойств для исследованных ранее клеток (эритроцитов, лейкоцитов и тимоцитов). Показано, что для всех исследованных клеток наблюдается характерная особенность - при переходе с увеличением температуры через область физиологических температур значения сил трения начинают существенно расти (существует «критическая» температура, значение которой зависит от типа и состояния клеток) (рисунок 1).
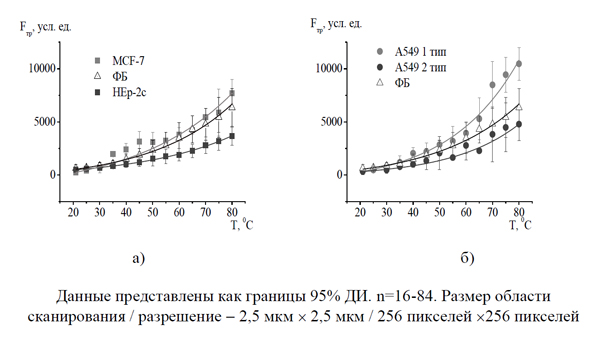
Значения сил трения для раковых и нераковых клеток, а также разных типов и подтипов раковых клеток различаются во всей исследованной области температур, включая область физиологических температур (p<0,05).
Определен комплекс параметров для характеристики с помощью атомно-силовой микроскопии физико-механических и геометрических свойств раковых и нераковых клеток: E, Fтр, σтр, Fа, DF карт сил трения скольжения и карт рельефа поверхности клетки, DF=φ(t), их контур, средний диаметр, высота и др.
Введено понятие физико-механического образа клеточной поверхности как обобщенной (базовой) ее характеристики, включающей комплекс получаемых методами АСМ параметров (сил трения, сил адгезии, модуля упругости, фрактальной размерности и др.) (рисунок 2).
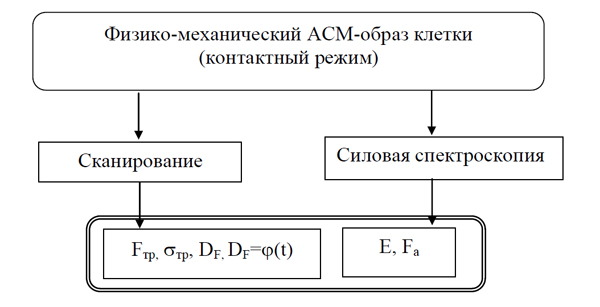
Изучено изменение физико-механического образа клеточной поверхности для раковых и нераковых клеток, предварительно обработанных глутаровым альдегидом. Для модифицированных глутаровым альдегидом клеток установлено уменьшение фрактальной размерности рельефа поверхности, средних значений сил трения и скорости их изменения при повышении температуры испытаний. Выявлено также увеличение фрактальной размерности карт латеральных сил, модуля упругости и силы адгезии при удлинении времени реакции клеток с глутаровым альдегидом. Анализ изменений физико-механического образа клеточной поверхности изученных раковых и нераковых клеток в зависимости от времени их реакции с глутаровым альдегидом и его концентрации свидетельствует об увеличении жесткости поверхностного слоя клеток, что можно объяснить ростом числа межмолекулярных сшивок в нем в результате реакции клеток с глутаровым альдегидом.
Установлено, что физико-механические образы поверхности исследованных раковых и нераковых клеток различаются. При температурах 20-30 °С значения параметров сил трения, адгезии, упругости и фрактальная размерность карт латеральных сил для раковых клеток (A549, HEp-2c, MCF-7) меньше, чем значения соответствующих параметров для фибробластов (р<0,05), что свидетельствует о большей степени мягкости раковых клеток и лабильности их цитоскелета в сравнении с фибробластами. Полученные данные хорошо согласуются с данными Fuhrmann A., Cross S.E. и других авторов, выявивших меньшие значения упругих свойств и сил адгезии клеток раковых линий в сравнении с клетками нормальных тканей [6-8].
Выявлено различие физико-механических образов разных типов и подтипов раковых клеток. На примере раковых клеток А549 показано, что даже различные популяции (подтипы) одного и того же типа раковых клеток могут существенно различаться по микромеханическим свойствам. Показано, что раковые клетки МCF-7 и A549 1-ого подтипа схожи по микромеханическим свойствам, а раковые клетки HEp-2c - соответственно имеют аналогию с раковыми клетками 2-ого подтипа. Получаемые с помощью АСМ параметры клеток могут, следовательно, использоваться для контроля однородности культуры клеток.
Вид патентной защиты: получен патент РБ №18895 от 28.02.2015 на изобретение «Способ определения температуры структурно-релаксационного перехода вещества», авторы: М.Н. Стародубцева, Н.И. Егоренков, А.А. Суслов, С.А. Чижик, заявители: ГомГМУ и ОДО «Микротестмашины». Получен патент РБ №20077 от 27.01.2016 (дата регистрации в ГРИ) «Способ определения патологии биологических клеток», авторы: М. Н. Стародубцева, Н. И. Егоренков, А. А. Суслов, А. И. Грицук, И. А. Никитина, заявители: ГомГМУ и ОДО «Микротестмашины».
Область применения: биофизика, медицина, образование.
Рекомендации по использованию: результаты исследований использованы в научно-исследовательском процессе НИЛ УО «Гомельский государственный медицинский университет» и технологическом процессе выпускающего атомно-силовые микроскопы ОДО «Микротестмашины». Результаты исследований использованы в защищенной в январе 2016 г. магистерской диссертации Стародубцева И. Е. «Методы расчета фрактальной размерности изображений поверхностей, полученных атомно-силовой микроскопией, и их программная реализация» (УО «Гомельский государственный университет им. Ф. Скорины»). Результаты исследований использованы в диссертации Стародубцевой М.Н. «Биофизические механизмы действия пероксинитрита в клетках крови», представленной на соискание ученой степени доктора биологических наук по специальности 03.01.02 — биофизика (Совет по защите диссертаций Д 01.37.01 в ГНУ «Институт биофизики и клеточной инженерии НАН Беларуси») и защищенной 27.06.2016.
Предложения по сотрудничеству: совместные исследования по дальнейшей разработке основанного на данных атомно-силовой микроскопии метода анализа типа и состояния раковых клеток с целью совершенствования диагностики онкологической патологии на клеточном уровне.