УДК: 616.12-089-008-085
Год издания: 2017
Сложности диагностики острого почечного повреждения у детей после кардиохирургических вмешательств с искусственным кровообращением
Рябушко Е.С., Байко С.В., Лесковский Д.В., Фирсова А.Г., Дроздовский К.В.
Рубрики: 76.29.30, 76.29.36, 76.29.39, 76.29.47
Республиканский научно-практический центр детской хирургии
Тема НИР: «Разработать и внедрить метод диагностики и лечения острого почечного повреждения у детей после операции на открытом сердце (ОНТП «Разработать и внедрить новые лечебно-диагностические и профилактические методы, направленные на охрану и укрепление здоровья матери и ребенка») («Здоровье матери и ребенка — богатство общества»)».
Сроки выполнения НИР: январь 2016 г. — декабрь 2018 г.
Научный руководитель: канд. мед. наук К.В. Дроздовский.
Источник финансирования: госбюджет.
Целью настоящего исследования является оценка нарушений функции почек у детей с врожденными пороками сердца (ВПС) после операций с использованием искусственного кровообращения (ИК) на основании динамики изменения традиционных и «новых» маркеров острого почечного повреждения (ОПП).
В настоящее время в проспективное исследование включено 19 детей, которым с января 2016 г. выполнялась хирургическая коррекция врожденного ВПС по поводу транспозиции магистральных сосудов, гипоплазии перешейка и дуги аорты, промежуточной и полной форм атриовентрикулярной коммуникации, изолированного дефекта межжелудочковой перегородки, клапанного стеноза легочной артерии, тетрады Фалло в условиях гипотермии и длительного ИК. Характеристика пациентов представлена в таблице 1.
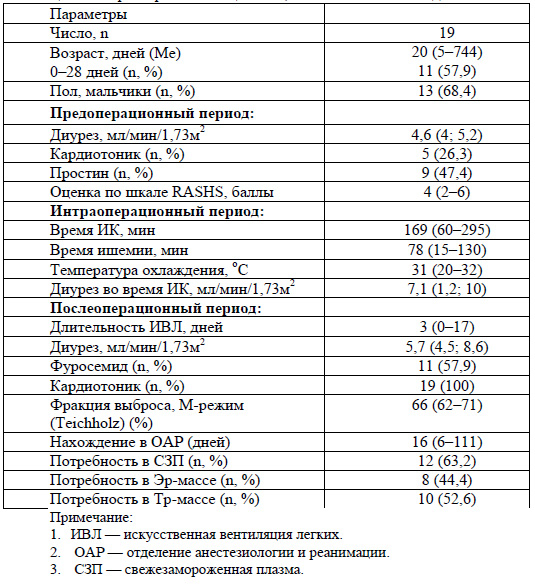
Как видно из таблицы 1, большинство детей (57,9%) прооперированы в период новорожденности, тяжесть состояния обусловлена длительностью использования ИВЛ - (Ме) 3 (0-17) дня, необходимостью назначения кардиотоников после операции в 100% случаев, переливанием СЗП, тромбоцитарной массы. Тяжесть состояния оценена высокими баллами по шкале RASHS. Вероятность почечного повреждения была высокой, учитывая длительность периода искусственного кровообращения - (Me) 169 (60-295) мин и время пережатия аорты - 78 (15-130) мин. У 57,9% детей применялся фуросемид для поддержания адекватного диуреза.
Искусственное кровообращение выполнялось на аппарате SystemI (Terumo, Бельгия) с использованием оксигенаторов (Medtronic, США, Terumo, Бельгия) в условиях гипотермии 32°С и ниже, с перфузионным индексом 2,0-1,8 л/мин×м2 и средним артериальным давлением 35-50 мм рт. ст. Первичный объем контура ИК заполняли 20% раствором альбумина, 15% раствором маннита, 8,4% раствором натрия гидрокарбоната, 7,5% раствором калия хлорида, раствором Рингера, гордоксом, 10% раствором хлоридам кальция, эритроцитарной массой, метилпреднизолоном 15 мг/кг. Для детей с массой тела менее 3 кг в объем заполнения включали свежезамороженную плазму. Стандартную ультрафильтрацию проводили в течение искусственного кровообращения и затем модифицированную ультрафильтрацию после его завершения - в каждом из случаев.
Пациенты оценивались с учетом шкалы RASHS. (Risk-Adjusted Congenital Heart Surgery) - система оценки риска летального исхода, скорректированной с учетом риска хирургии врожденного порока сердца у детей до 18 лет, перенесших операцию на сердце.
Исследование уровней креатинина, цистатина С, нейтрофильного желатиназоассоциированного липокалина (NGAL) мочи (uNGAL) осуществляли в четырех временных периодах:
а) непосредственно перед операцией;
б) от 0 до 6 ч после завершения операции;
в) от 7 до 24 ч после операции;
г) от 25 до 48 ч после операции.
Диагностика ОПП осуществлялась в соответствии с KDIGO и RIFLE классификациями.
Для анализа полученных данных использовалась непараметрическая статистика с вычислением медианы и квартилей. Различия считали достоверными при p<0,05. Данные обрабатывались с использованием программы Statistica 10, Microsoft Excel 2010.
Анализ изменений концентрации сывороточного креатинина показал его существенное повышение выше исходных значений в периоды 7-24 ч (р<0,01) и 25-48 ч (р<0,05) (таблица 2).
Степень нарастания концентрации креатинина в крови также была максимальной в периоды 7-24 и 25-48 ч по сравнению как с исходными данными (<0,01), так и периодом 0-6 ч (<0,05) (таблица 2).

Индивидуальный анализ степени нарастания концентрации креатинина выявил, что ни у одного из пациентов показатель не повышался более чем в 1,5 раза от исходного в интервале 0-6 ч после операции. В интервале 0-24 ч увеличение уровня Cr в 1,5-2 раза выше исходного отмечено у 1 (5,3%) ребенка, а у 4 (21,1%) - в 2-3 раза; кроме того, повышение более чем на 26,5 мкмоль/л определялось у всех 5 детей. В интервале 0-48 ч у 3 человек содержание Cr снизилось до исходных значений, у 2 оно сохранялось выше начального уровня в 1,56 и 3,19 раза - данный пациент потребовал начала заместительной почечной терапии (ЗПТ) в 1-е сут после операции из-за развития олигоанурии, а у 2 детей показатель вырос в 1,73 и 1,62 раза выше исходного. У всех 4 детей уровень Cr также превышал исходный более чем на 26,5 мкмоль/л. Таким образом, с учетом KDIGO классификации ОПП данный диагноз устанавливался 7 (36,8%) пациентам: 1-й стадии - 3 (15,8%), 2-й - 3 (15,8%) и 3-й - 1 (5,3%).
Концентрация цистатина С (CysC) в крови у детей в первые 6 ч после кардиохирургического вмешательства снижалась с последующим существенным его нарастанием в сравнении с исходным к 25-48 ч (таблицы 3 и 4).
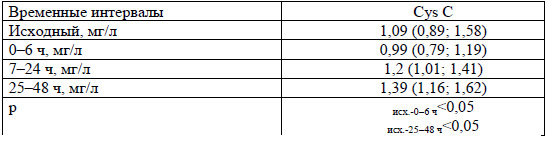
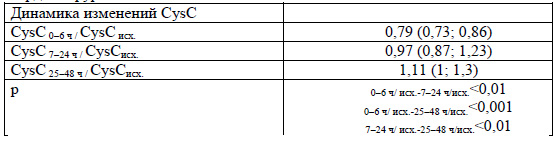
При индивидуальной оценке изменений цистатина С после коррекции ВПС установлено превышение исходного уровня более чем в 1,5 раза у 2 пациентов: у первого - в 1,58, 1,71 и 2,17 раза в 0-6, 7-24 и 25-48 ч (нуждался в ЗПТ) и у второго - в 1,57 и 2,2 раза в 7-24 и 25-48 ч. С учетом этих данных ОПП можно диагностировать только у 2 (10,5%) пациентов.
Анализ маркера почечного повреждения NGAL в моче (uNGAL) выявил его существенное повышение в первые 6 ч после операции (р<0,001) (таблица 5), что отражает повреждение проксимальных почечных канальцев в условиях длительной ишемии на фоне искусственного кровообращения.
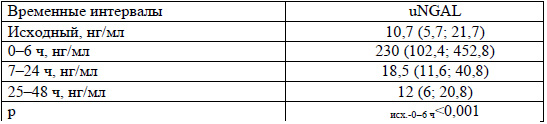
Для выявления взаимосвязи между uNGAL и креатинином крови были проанализированы концентрации uNGAL в интервале 0-6 ч после операции в зависимости от степени повышения уровня креатинина (превышение до и более чем в 1,5 раза от исходного) в интервале 7-48 ч (рисунок). В группе с превышением содержания креатинина более чем в 1,5 раза от исходного уровни uNGAL были значимо выше (449,5 (219,4; 745) против 139 (83,3; 337,3) нг/мл, р<0,05). Выявлена средней силы корреляционная связь между uNGAL и креатинином крови (rs=0,5, р<0,05).
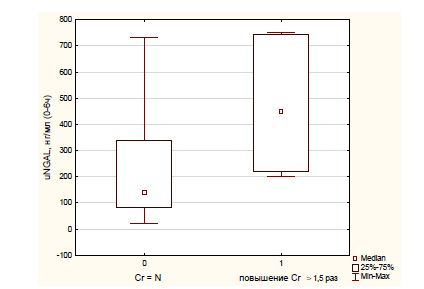
Одним из критериев ОПП в ранее использовавшейся классификации pRIFLE служило снижение рСКФ по отношению к исходным данным (>25% - R, >50% - I, >75% - F). При индивидуальной оценке каждого из пациентов ОПП диагностируется у 8 (42,1%) детей: R (1-я стадия) - 5 (26,3%), I (2-я стадия) - 3 (15,8%).
На основании проведенного исследования было установлено:
- диагноз ОПП с учетом классификации KDIGO установлен 7 (36,8%) пациентам: 1-й стадии - 3 (15,8%), 2-й - 3 (15,8%) и 3-й - 1 (5,3%);
- при оценке динамики нарастания уровня цистатина С крови диагноз ОПП можно установить только 2 (10,5%) пациентам;
- при анализе рСКФ, рассчитанной на основании концентрации креатинина крови, частота ОПП составила 42,1% (8 детей): 1-я стадия - 5 (26,3%), 2-я - 3 (15,8%);
- ранний маркер повреждения почек uNGAL максимально увеличивался в моче в первые 6 ч у детей после кардиохирургических вмешательств с использованием искусственного кровообращения и тесно коррелировал с повышением уровня креатинина крови в последующие 7-48 ч, отражая наличие и тяжесть ОПП.
На основании изучения маркеров почечного повреждения у детей после кардиохирургических вмешательств с искусственным кровообращением можно сделать вывод, что определение NGAL мочи и цистатина С крови позволяет диагностировать ОПП уже в первые 6 ч после операции. Требуется дальнейшее исследование для определения степени значимости этих маркеров.
Область применения: кардиохирургия.
Рекомендации по использованию: результаты исследования могут быть использованы для оценки функции почек при хирургическом лечении детей.
Предложения по сотрудничеству: консультативная помощь при внедрении.