УДК: 616-018.4-091-089.843:616.13/.16
Год издания: 2017
Васкуляризация биотрансплантатов, используемых для замещения дефектов костной ткани
Данилкович Н.Н., Космачева С.М., Северин И.Н., Деркачев В.С.
Рубрики: 76.29.33, 76.29.41
Республиканский научно-практический центр трансфузиологии и медицинских биотехнологий
Тема НИР: «Разработать метод васкуляризации костных трансплантатов на основе мезенхимальных стволовых и эндотелиальных клеток».
Сроки выполнения НИР: май 2014 г. — март 2016 г.
Научный руководитель: И.Н. Северин.
Источник финансирования: госбюджет.
В последнее десятилетие ведется активный поиск новых биоматериалов, способных стать альтернативой костным аутотрансплантатам, а так же разрабатываются различные комбинации тканеинженерных конструкций (ТИК), которые содержат в своем составе синтетические материалы (металлические, полимерные и биокерамика), мезенхимальные стволовые клетки (МСК) и биоактивные молекулы (факторы роста, костные морфогенетические белки или плазма, обогащенная тромбоцитами). Однако регенерационный остеогистогенез осуществляется при обязательном участии растущих кровеносных сосудов и зависит от условий васкуляризации. Значительный успех в клинических исследованиях будет достигнут при достаточном кровоснабжении внутри предлагаемых ТИК. Предполагается, что ассоциация ангиогенных клеток с клетками остеобластоидного ряда в составе ТИК поможет решить проблему недостаточности васкулогенеза, так как оба типа клеток участвуют в образовании сосудов de novo.
Цель исследования - разработать метод васкуляризации биотрансплантата костной ткани, содержащего МСК и эндотелиальные клетки (ЭК).
Разработан метод васкуляризации биотрансплантата для замещения костной ткани, основанный на включении в его состав МСК и эндотелиальных клеток в соотношении 1:1.
Для разработки метода использовали МСК костного мозга человека. МСК получали из мононуклеарной фракции костного мозга путем адгезии на пластике. Для наращивания МСК использовали среду α-МЕМ с 5%-й сывороткой АВ (IV) человека и антибиотиками.
Культуры ЭК получали из пуповин новорожденных, предоставленных родильным отделением ГУ РНПЦ «Мать и дитя». Пуповинную вену заполняли 0,1% раствором коллагеназы I. ЭК собирали в пробирку путем перфузии полости вены фосфатно-солевым буферным раствором (ФСБ) с 2%-й сывороткой АВ (IV). Клетки вносили во флаконы Т75, предварительно обработанные 0,1%-м раствором желатина на фосфатно-солевом буфере в модификации Дульбекко (ФСБ-Д) в концентрации 3,0х103/см2. Культуру ЭК наращивали в среде М199 с добавлением 10%-й сыворотки АВ (IV), гидрокортизон-21-гемисукцината (1 мкг/мл), гепарина (5 ед./мл), L-аскорбиновой кислоты (0,25 мМ), фактора роста фибробластов (bFGF) и эпидермального ростового фактора (EGF) по 10 нг/мл, антибиотиков. Среду меняли каждые 3-е сут.
Все эксперименты по совместному культивированию МСК и ЭК проводили в 24-луночных планшетах в среде М199 с добавлением 10%-й сыворотки АВ (IV) и антибиотиков в течение 7 дней. МСК и ЭК культивировали в соотношениях 1:3, 1:1 и 3:1. В качестве контролей использовали монокультуру ЭК и МСК.
При микроскопическом анализе показано, что при сокультивировании МСК и ЭК в соотношении 1:3 и 3:1 на 3-й день происходит формирование сети МСК и диффузное расположение на адгезионной поверхности умеренно плотных скоплений ЭК с конфлюэнтностью 30%. Через 7 дней культивирования происходило уплотнение клеточного монослоя до 50%.
При культивировании МСК и ЭК в соотношении 1:1 на 3-й день со-культура формировала многочисленные дискретные скопления ЭК, располагающиеся в ячейках сети МСК. Плотность роста к 3-му дню составляла около 40%, а к 7-му дню - 95% .
Клетки в моно- и сокультурах экспрессировали характерные для своего типа маркеры, а именно: для МСК - CD 90, для ЭК - CD 31, CD309 и фактор фон Виллебранда (vWf). CD105 экспрессировали как МСК, так и ЭК. Через 7 дней культивирования сокультуры МСК:ЭК в соотношении 1:1 наблюдали сохранение в культуре двух типов клеток, что подтверждается экспрессией специфичных поверхностных маркеров. В соотношениях МСК:ЭК 1:3 и 3:1 по окончании сокультивирования в культурах преобладали МСК.
Различия в пролиферативном потенциале клеток отмечены при анализе числа генераций и времени удвоения (таблица).
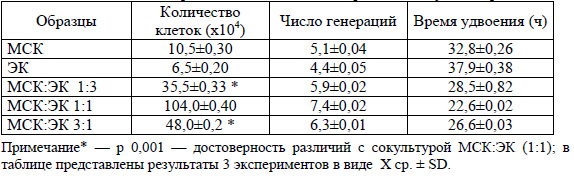
Как видно из таблицы, при культивировании МСК и ЭК в соотношении 1:1 количество клеток, снятых с флакона в конце эксперимента, было в 2,1 раза больше, чем при соотношении МСК:ЭК 3:1 (p<0.001), и в 2,9 раза больше, чем при соотношении МСК:ЭК 1:3 (p<0.001). При данном соотношении число генераций было самым высоким (7,4±0,02), а время удвоения самим низким (22,6±0,02).
Нами было показано, что МСК костного мозга человека могут дифференцироваться в эндотелиальном направлении при культивировании в среде α-МЕМ с 2%-й сывороткой АВ (IV) в присутствии фактора роста эндотелия сосудов (VEGF) (50 нг/мл), FGF и EGF в концентрации 10 нг/мл каждого, что подтверждено снижением экспрессии CD90 до 66,1% (n=3, p<0.04) и повышением содержания CD90+/CD31+ в 7,8 раза (n=3, p<0,04) по сравнению с интактными МСК.
Культуры МСК и ЭК в соотношении 1:1 были использованы в составе биотрансплантата для заживления дефектов костной ткани на модели краевого дефекта лучевой кости длиной 1,5 см с удалением надкостницы и костно-мозгового канала у кроликов. Контролем служил дефект кости, заполненный остеопластическим материалом без клеточного материала и других индукторов остеогенеза, и дефект, заживающий под кровяным сгустком. Восстановление костного дефекта оценивали гистологическим методом (окраска гематоксилин-эозином) через 1 и 3 мес. после имплантации биотрансплантата.
В группах сравнения на 1 мес. наблюдения дефект остался незаполненным, а к 3 мес. отмечались признаки начинающейся репаративной регенерации, осуществляемой путем десмогенеза и без остеогенеза, что в целом затягивало регенерацию костной раны. Заживление дефекта костной ткани, замещенного биотрансплантатом на основе костно-замещающей матрицы «Коллапан» (в виде гранул), сокультуры МСК:ЭК (1:1) и лизата тромбоцитов происходило по смешанному типу с образованием хрящевой ткани, миелоидного костного мозга, групп дистрофичных жировых клеток (компоненты жирового костного мозга) с участками инкапсуляции материала в 1 мес наблюдения. К 3 мес. в опытной группе отмечено формирование новообразованной костной ткани, объемных полостей с ретикулярной стромой и клеточным компонентом костного мозга (костномозговые полости), а также наличие спонгиоза (полиморфные и полнокровные сосудистые каналы).
Таким образом, соотношение МСК и ЭК 1:1 при культивировании in vitro и использовании в составе биотрансплантата является оптимальным, при котором наблюдается максимальное увеличение количества клеток к 7-му дню культивирования, сохраняются и пролиферируют оба типа клеток, восстановительные процессы в костной ткани идут более активно.
Область применения: травматология, хирургия, клеточные биотехнологии.
Рекомендации по использованию: рекомендуется использовать для замещения больших дефектов трубчатых костей при длительном несращении переломов, образовании ложных суставов.
Предложения по сотрудничеству: консультативная помощь при внедрении, совместные исследования по созданию новых биотрансплантатов.