УДК: 616.71-006.3.04-079.4-036
Год издания: 2017
Экспрессия молекулярных маркеров а ткани опухоли в качестве прогностического фактора при саркомах костной ткани
Киселев Л.П., Савицкая Т.В., Жуковец А.Г., Алейникова О.В.
Рубрики: 34.15.51, 76.29.49
Республиканский научно-практический центр детской онкологии и гематологии
Тема НИР: «Разработать и внедрить комплексный метод раннего распознавания прогностически неблагоприятных форм сарком костной ткани для усиления терапии на основании индивидуальных биологических характеристик опухолевого процесса».
Сроки выполнения НИР: 01.01.2013 г. — 31.12.2017г.
Научный руководитель: д-р. мед. наук, проф. О.В. Алейникова, канд. мед. наук А.Г. Жуковец.
Соисполнители: ГУ «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии», ГУ «Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова».
Источник финансирования: госбюджет, ГНТП «Новые методы оказания медицинской помощи» 2016-2020 годы», подпрограмма «Онкологические заболевания» (договор № 02.14 от 05.03.2013).
Саркомы костей (остеосаркома [ОС] и саркома Юинга [СЮ]) имеют общий мезенхимальный источник происхождения, но это разные нозологии с клиническими и биологическими различиями. Понимание молекулярно-генетических аспектов биологического поведения опухоли представляется на сегодняшний день перспективным направлением как для прогнозирования индивидуального клинического исхода заболевания, так и для поиска новых мишеней терапевтического воздействия. Гены MGST1 и GSTM4 относятся к семейству глютатион-S-трансфераз и кодируют энзимы, контролирующие механизм химиорезистентности посредством детоксикации и ингибирования апоптоза опухолевой клетки.
Целью исследований был поиск различий в уровне экспрессии мРНК (матричной рибонуклеиновой кислоты) генов MGST1 и GSTM4 в субстрате опухоли у пациентов с саркомами костей и мягких тканей в зависимости от вида нозологии, распространенности онкологического процесса и клинического исхода заболевания. Методом РТ-ПЦР (полимеразная цепная реакция в реальном времени) исследованы 77 образцов от 73 пациентов (возраст до 30 лет) с СЮ (n=48), и ОС (n=25). Отмечен значимо более высокий медианный уровень экспрессии (n=48) как гена MGST1, так и GSTM4 при СЮ по сравнению с ОС (p<0,05). Установлен меньший (в сравнении с пациентами, развившими рецидив) уровень экспрессии гена MGST1 при благоприятных исходах локализованной СЮ (p<0,05). семилетняя бессобытийная выживаемость (БСВ) пациентов с низким уровнем экспрессии мРНК гена MGST1 составила 93,3%; с высокой экспрессией значение показателя БСВ было 48,3% (р<0,05). Констатировано, что экспрессия мРНК генов MGST1 и GSTM4 в ткани сарком демонстрирует значимость в качестве компонентов дифференциальной диагностики, а экспрессия гена MGST1 может являться фактором прогнозирования клинического исхода при локализованных формах СЮ.
Введение
Остеосаркома и саркома Юинга имеют общий мезенхимальный источник происхождения, но, это разные нозологии с клиническими и биологическими отличиями. Исследования последнего десятилетия свидетельствуют о наличии общих генетических особенностей для СЮ и ОС, так же как и других сарком опорно-двигательного аппарата (рабдомиосаркомы, синовиальной саркомы и т.д.). Также объединяющими аспектами являются клиническое поведение и результаты терапии этих новообразований. Как правило, саркомы являются высокозлокачественными опухолями с высоким потенциалом к метастазированию в легкие, кости, костный мозг, лимфатические узлы и т.д. Мультидисциплинарный подход, подразумевающий достижения в системной химиотерапии, хирургическом и радиологическом лечении, сопроводительной терапии позволил достичь показателей выживаемости до 60-70% для локализованных (неметастатических) форм заболевания. Однако для пациентов с отдаленными метастазами на момент установления диагноза результаты являются крайне неудовлетворительными, и количество благоприятных исходов терапии не превышает 15-25%. Эти показатели остаются практически неизменными на протяжении последних десятилетий, что заставляет констатировать отсутствие значимого прогресса в курации исследуемых нозологий. Наиболее значимым критерием клинического исхода заболевания является наличие метастатического распространения, и для таких пациентов, как правило, осуществляется поиск новых лечебных агентов и терапевтических опций. Для локализованных форм ситуация иная, поскольку около 2/3 случаев может быть успешно излечено с помощью уже разработанных стандартных лечебных подходов. Интенсификация лечения и увеличение токсичности для таких пациентов нецелесообразно, но необходимо для той трети случаев, которые развивают резистентность к стандартному лечению и рецидивируют в ранние сроки наблюдения. Классические клинические характеристики (пол, возраст, размер и локализация новообразования, уровень лактатдегидрогеназы, щелочной фосфатазы и др.) имеют ограниченное прогностическое значение вследствие достаточно широкого диапазона показателей; в базовых современных протоколах системная терапия, как правило идентична у всех пациентов с локализованными формами заболевания.
Молекулярно-генетические аспекты биологического поведения новообразования представляются на сегодняшний день перспективным направлением как для прогнозирования индивидуального клинического исхода заболевания, так и для поиска новых мишеней терапевтического воздействия.
Семейство глютатион-S-трансфераз (GSTs, glutathione S-transferase) объединяет энзимы, основной функцией которых является детоксикация широкого спектра экзо- и эндогенных компонентов. Семейство GSTs весьма гетерогенно и включает в себя 8 подсемейств: α (GSTAs), κ (GSTKs), µ (GSTMs), ω (GSTOs), π (GSTPs), θ (GSTTs), ζ (GSTZs) и мембран-ассоциированные GSTs (MGSTs). Механизм развития резистентности осуществляется посредством конъюгации глютатиона с цитостатиками и экстрадиции их из опухолевой клетки. Также позднее описан еще один механизм функционирования генов этого семейства - блокирование лекарственно-индуцированного апоптоза не через субстрат GST, а посредством ингибирования MAP-киназ (MAP, Мitogen-Аctivated Protein kinase).
В качестве субъектов настоящего исследования определены гены MGST1 (microsomal GST1) и сравнительно недавно открытый GSTM4 (glutathione S-transferase M4), поскольку к настоящему моменту представлены данные об их влиянии на механизм химиорезистентности при злокачественных новообразованиях. Экспрессия генов MGST1 и GSTM4 ассоциируется с резистентностью в первую очередь к доксорубицину и цисплатину, ключевым компонентам системной терапии мускульно-скелетарных сарком. Также следует принимать во внимание, что к настоящему моменту разработан и находится на этапе тестирования новый терапевтический агент NBDHEX (6-(7-nitro-2,1,3-benzoxadiazol-4-ylthio) hexanol), который показал эффективность в ингибировании энзимов семейства GST.
Предметом настоящего исследования стало определение уровня экспрессии мРНК генов MGST1 и GSTM4 в опухолевой ткани пациентов с костными и мягкоткаными саркомами.
Материал и методы
Пациенты.Исследуемые группы были сформированы с 2006 по 2015 г и состояли из пациентов детского возраста и молодых взрослых (до 30 лет), которым был установлен диагноз саркомы костей или мягких тканей в Республиканском научно-практическом центре детской онкологии, гематологии и иммунологии Минздрава РБ и Республиканском научно-практическом центре онкологии и медицинской радиологии им. Н.Н. Александрова Минздрава РБ. Исследование одобрено локальными этическими комитетами. В исследование включено73 пациента. С диагнозом СЮ 48 (65,8%) пациентов, с диагнозом ОС - 25 (34,2%). Медиана возраста составила 17,1 года (min 0,53 года - max 29,7 года); лиц мужского пола было 42 (57,5%), женского - 31 (42,5%). В результате диагностического оперативного вмешательства (биопсии) до начала специального лечения были получены 77 образцов тканей опухолевых очагов. От лиц с впервые установленным диагнозом саркомы взяты 71 (92,2%) образец; от 4 пациентов (все с СЮ) получены образцы опухоли как при первичной диагностике (4 - 4,0% образца), так и при рецидиве (4 - 4,0% образца) заболевания; у 2 (2,0%) пациентов (все с СЮ) образец опухоли получен только при рецидиве заболевания. Критериями включения пациентов в исследование было морфологическое подтверждение диагноза и наличие достаточного количества материала для молекулярно-биологического исследования. При изучении влияния метастатического распространения и нозологии процесса на уровень экспрессии мРНК генов MGST1 и GSTM4 обследованы 71/73 (97,2%) пациента с саркомами (исключены двое с СЮ, у которых образец опухоли получен только при рецидиве заболевания), 61 - с локализованными, и 10 - с метастатическими формами.
В исследование, по изучению влияния уровня экспрессии мРНК генов MGST1 и GSTM4 на клинический исход заболевания включено 63/73 (86,3%) пациента, получивших предусмотренную протокольную системную терапию и локальный контроль: операция (при необходимости с заместительным эндопротезированием) и/или лучевая терапия. Исключены 10 пациентов (n=2, оба с СЮ), у которых материал опухоли получен только при рецидиве заболевания, и случаи (n=8, все с СЮ), которые на момент анализа не достигли 2 летнего срока наблюдения в ремиссии. Из 63 случаев в ремиссии более 2-х лет находились 37 (58,7%) человек; у 26 (41,3%) имел место рецидив заболевания. Распределение пациентов по нозологиям и распространенности процесса при изучении влияния уровня экспрессии мРНК генов MGST1 и GSTM4 на клинический исход заболевания представлено в таблице 1.
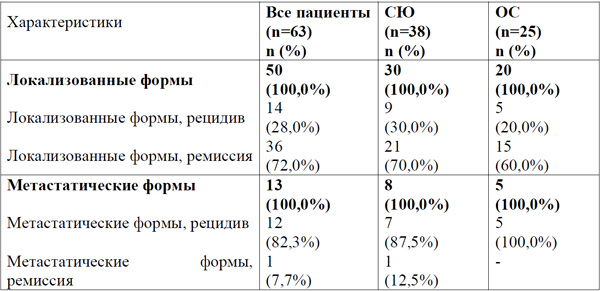
Системная химиотерапия для пациентов с ОС предусматривала использование доксорубицина, цисплатина, метотрексата, ифосфамида и этопозида. Для пациентов с СЮ использовались доксорубицин, ифосфамид, этопозид, винкристин, дактиномицин. Длительность БСВ исчислялась от времени установления инициального диагноза.
Методы исследования
Выделение РНК и синтез кДНК
Образцы тканей были получены непосредственно после операции и заморожены в жидком азоте. Общую РНК выделяли с использованием RNeasy Mini Kit (Qiagen, xx, Germany) согласно инструкции производителя. Количественные показатели концентрации РНК оценивались посредством спектрофотометрии. Общую РНК (1,5 мкг) из опухолевой ткани конвертировали в первую цепь ДНК с использованием случайного праймера (0,3 мкг) и обратной транскриптазы (200 U) мышиного вируса лейкемии (Moloney murine leukemia virus, M-MLV; Promega, ХХ, USA).
Количественная обратно-транскриптазная полимеразная цепная реакция
ПЦР в реальном режиме времени для генов MGST1 и GSTM4 проводили с использованием коммерческих систем (TaqMan Gene Expression Assays; Applied Biosystems, Foster City, CA) в соответствии с протоколом производителя на оборудовании Icycler (Bio-Rad, Hercules, CA). Относительные величины мРНК генов в образцах рассчитаны по показателям стандартных кривых, полученных путем амплификации серийного разведения обратно транскрибированной общей РНК. Значения исследованных показателей представлены в виде относительных величин. В качестве внутреннего контроля использовали ген глицеральдегид-3-фосфатдегидрогеназы (GAPDH).
Статистический анализ
Статистический анализ данных проводился с помощью программы «R-statistics» версия 3.2.0, R Foundation for Statistical Computing, лицензия GNU GPL. Оценка статистической значимости различий между сравниваемыми количественными показателями выполнялась критерием U-тестом Манна-Уитни. Сравнение в группах по индивидуальным параметрам проводилось с помощью χ2-теста. Для оценки выживаемости пациентов применялся метод Kaplan-Meier. Различия в выживаемости оценивались с использованием log-rank теста. Все различия считались статистически значимыми при р<0,05.
Результаты и обсуждение
Экспрессия мРНК генов MGST1 и GSTM4 в зависимости от нозологии онкологического процесса представлена на рисунке 1.
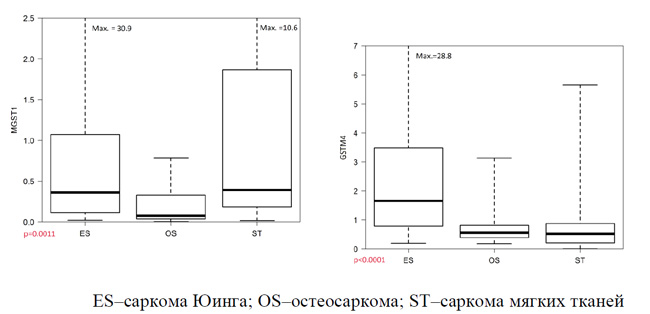
Как представлено на рисунке 1, медианный уровень экспрессии гена MGST1 у лиц с СЮ (0,38) был значительно выше, чем таковой при ОС (0,09). При оценке экспрессии гена GSTM4 также наблюдался более высокий уровень у пациентов с СЮ (1,54) по сравнению с ОС (0,53). Анализ экспрессии исследуемых генов при саркомах мягких тканей в настоящей работе не проводился. Можно констатировать, что для СЮ в отличие от ОС характерна значимо более высокая активность обоих генов: MGST1 и GSTM4.
Экспрессия гена MGST1 была оценена в когортах пациентов в зависимости от наличия метастатического распространения на момент установления диагноза, а также клинического исхода заболевания. Сравнительная характеристика уровней экспрессии мРНК гена MGST1 в ткани опухоли перед началом терапии в когортах пациентов в зависимости от наличия метастатического распространения и клинического исхода заболевания представлена в таблице 2.
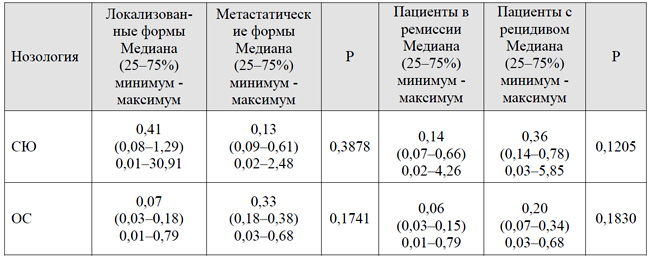
Как представлено в таблице 2, наиболее значимая разница в экспрессии гена MGST1 наблюдалась у пациентов с ОС (0,07 vs 0,33). Для пациентов с СЮ констатированы более высокие уровни экспрессии MGST1 при локализованных формах заболевания по сравнению с метастатическими (0,41 vs 0,13). Для лиц, находящихся в ремиссии, отмечены более низкие уровни экспрессии гена MGST1 в обеих сравниваемых группах.
Экспрессия гена GSTM4 была оценена в когортах пациентов в зависимости от наличия метастатического распространения на момент установления диагноза, а также от клинического исхода заболевания. Сравнительная характеристика уровней экспрессии мРНК гена GSTM4 в ткани опухоли перед началом терапии в когортах пациентов в зависимости от наличия метастатического распространения и клинического исхода заболевания представлена в таблице 3.
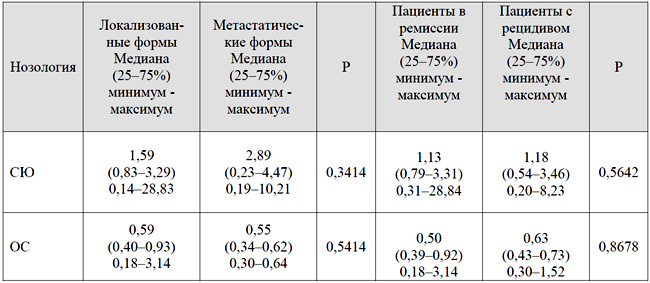
Оценивая результаты, приведенные в таблице 3, можно отметить, что при сравнительном анализе когорт пациентов с локализованными и метастатическими формами практически не отмечено разницы в медианных уровнях экспрессии при ОС (0,59 vs 0,55). Для локализованных форм СЮ активность гена GSTM4 была меньше, чем при метастатических (1,59 vs 2,89).
Наличие в банке опухолей, полученных при рецидиве (доступны образцы только СЮ), позволило осуществить сравнительный анализ уровня экспрессии генов MGST1 и GSTM4 у первичных пациентов и при возврате заболевания.
Экспрессия мРНК генов MGST1 и GSTM4 у первичных пациентов с локализованными формами СЮ в зависимости от исхода заболевания, а также лиц с рецидивными опухолями представлена на рисунке 2.
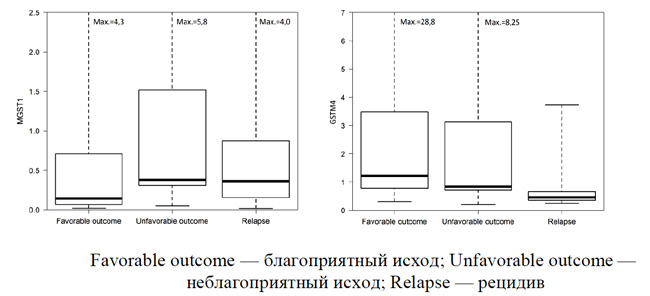
Как представлено на рисунке 2, уровень экспрессии гена MGST1 был ниже у пациентов с благоприятным клиническим исходом СЮ; у первичных пациентов с неблагоприятным исходом и при рецидиве заболевания медианы экспрессии были практически идентичными. При оценке экспрессии гена GSTM4 отмечен несколько более высокий уровень при благоприятных исходах по сравнению с неблагоприятными. В рецидивных опухолях медиана экспрессии GSTM4 была минимальной, и большинство количество случаев показывало уровень экспрессии (0,62) менее, чем значение 1-й квартили когорт пациентов как при благоприятных (0,83), так и неблагоприятных (0,74) исходах. Можно констатировать, что при СЮ низкая активность гена MGST1 ассоциируется с благоприятными клиническими исходами. Уровень экспрессии GSTM4 не имеет значительных различий у первичных пациентов в зависимости от клинического исхода, но более такового при рецидивах заболевания.
Особый клинический интерес представляло сравнение уровней экспрессии у первичных пациентов именно с локализованными формами сарком в зависимости от исхода заболевания. Пациенты были разделены на две когорты: с благоприятным (находятся в ремиссии) и неблагоприятным (развился рецидив) клиническими исходами.
Экспрессия мРНК гена MGST1 у первичных пациентов с локализованными формами сарком в зависимости от исхода заболевания представлена на рисунке 3.
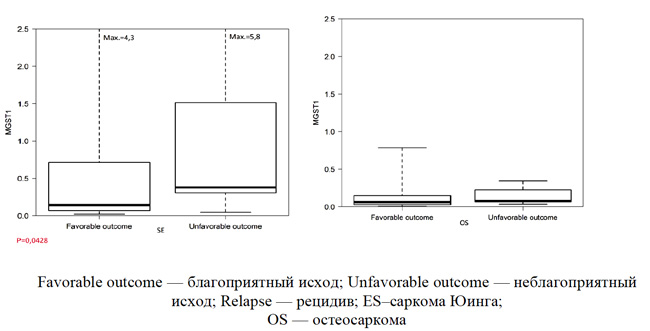
Как представлено на рисунке 3, медианный уровень экспрессии гена MGST1 был более чем в 2 раза ниже у пациентов с благоприятным клиническим исходом СЮ (0,14 vs 0,38, р<0,05). Для пациентов с ОС разница в экспрессии в сравниваемых группах практически отсутствовала (0,07 vs 0,06). Как уже было представлено (рисунок 1), экспрессия изучаемого гена при ОС оказалась значительно меньше, чем при СЮ.
Была также изучена экспрессия мРНК гена GSTM4 у первичных пациентов с локализованными формами сарком в зависимости от исхода заболевания. Уровень экспрессия мРНК гена GSTM4 у первичных пациентов с локализованными формами сарком в зависимости от исхода заболевания представлена на рисунке 4.
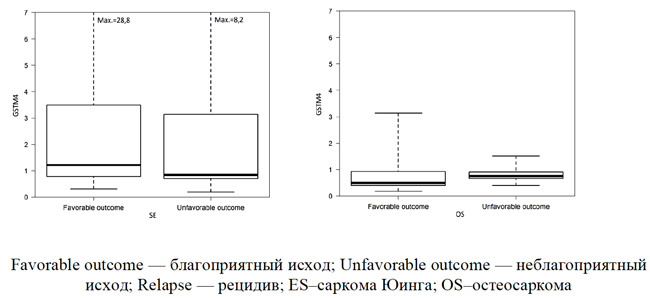
Как представлено на рисунке 4, медианные уровни экспрессии мРНК гена GSTM4 значимо не различались в группах благоприятного и неблагоприятного исхода у пациентов с локализованными формами СЮ (1,21 vs 0,84) и ОС (0,50 vs 0,76). Можно констатировать, что активность гена GSTM4 не позволяет уверенно прогнозировать клинический исход заболевания при локализованных формах сарком.
Были определены показатели выживаемости пациентов с локализованными формами СЮ в зависимости от уровня мРНК гена MGST1 в ткани опухоли перед началом терапии. В качестве значения, определяющего высокую или низкую экспрессию гена MGST1, было отмечено значение нижней квартили (0,30) когорты пациентов с неблагоприятным клиническим исходом (выделяют 87,5% пациентов с неблагоприятным клиническим исходом).
БСВ пациентов с локализованными формами СЮ в зависимости от уровня мРНК гена MGST1 в ткани опухоли перед началом терапии представлена на рисунке 5. Неблагоприятными событиями в исследуемой когорте были только рецидивы заболевания; смертей в ремиссии и других отрицательных событий не констатировано.

Как представлено на рисунке 5, БСВ всей когорты пациентов с локализованными формами СЮ составила 70,2%. Показатель 7-летней БСВ пациентов с низким (≤0,30) уровнем экспрессии мРНК гена MGST1 составил 93,4%; с высоким (>0,30) 48,3% (p<0,05).
Таким образом, костные саркомы представляют группу гетерогенных заболеваний с источником развития мезенхимальной природы. Несмотря на существующие алгоритмы морфологической диагностики при установлении онкологического диагноза, до настоящего времени остается актуальным вопрос: могут ли быть обнаружены какие-либо дополнительные маркеры, способствующие дифференциальной диагностике изучаемых нозологий. Но наиболее актуальной задачей современной онкологии является поиск молекулярных маркеров с целью стратификации пациентов на прогностические группы и обнаружения мишеней для персонального целевого воздействия. В настоящем исследовании были изучены уровни экспрессии генов MGST1 и GSTM4, представителей семейства глютатион-s-трансферазы, функцией которых является детоксикация и стимулирование антиапоптотических регуляторов клеточного цикла. Исследование Scotlandi et al. (30 первичных локализованных и 7 метастатических форм СЮ) показало возможность влияния уровня экспрессии генов семейства GST, в частности MGST1, на риск возникновения рецидива. Luo et al. описали активность GSTM4 при развитии химиорезистентности мягкотканых и костных сарком. Pasello at al. представили взаимосвязь гиперэкспрессии генов GST и худших клинических исходов для пациентов с ОС. Seitz at al. продемонстрировали взаимосвязь раннего развития возврата у пациентов с рабдомиосаркомой и другими мягкоткаными новообразованиями при активности глютатион-s-трансфераза ассоциированных энзимов.
Уровни экспрессии мРНК генов MGST1 и GSTM4 были изучены в ткани сарком перед началом системной терапии у 73 пациентов до 30-летнего возраста. Экспрессия сравнивалась в зависимости от нозологии опухолевого процесса, наличия метастатического распространения и клинического исхода заболевания. Отмечен более чем на порядок низкий уровень экспрессии исследуемых генов при ОС по сравнению с СЮ, констатирована возможность использования этого критерия при дифференциальной диагностике заболеваний. Уровень активности в зависимости от метастатического распространения наиболее различался у пациентов с ОС (для гена MGST1) и с СЮ (для гена GSTM4). Меньший уровень экспрессии MGST1 (для GSTM4 различий не было) отмечен для пациентов с СЮ и ОС, находящихся в ремиссии по основному заболеванию. При исследовании только когорты с локализованными формами констатированы значимые различия в экспрессии гена MGST1 для пациентов с СЮ в зависимости от клинического исхода заболевания. Локализованные формы СЮ с благоприятным исходом продемонстрировали меньший уровень экспрессии MGST1, чем группа с неблагоприятным исходом и опухоли, полученные при рецидиве. Показатель 7-летней БСВ пациентов с локализованными формами СЮ и низким уровнем экспрессии мРНК гена MGST1 составил 93,3%; для случаев с высокой экспрессией - 48,3% (p<0,05). Таким образом, продемонстрирована возможность прогнозирования у пациентов с локализованными формами СЮ с неблагоприятным исходом заболевания непосредственно на этапе первичной диагностики с целью своевременной интенсификации. Значимых различий активности гена GSTM4 при локализованных формах СЮ, ОС и СМТ в зависимости от клинического исхода заболевания не продемонстрировано.
ВЫВОДЫ
Показана большая клиническая значимость уровня экспрессии гена MGST1 в сравнении с геном GSTM4. Экспрессия мРНК генов MGST1 и GSTM4 в ткани сарком демонстрирует значимость в качестве компонентов дифференциальной диагностики, а экспрессия гена MGST1 может рассматриваться в качестве фактора прогнозирования клинического исхода при локализованных формах саркомы Юинга.