УДК: 616.41–018.4–089.843:616; 71–018.4–003.93]: 616.718.4–002.4–053
Год издания: 2019
Мезенхимальные стволовые клетки в фибриновом геле для регенерации костной ткани
Исайкина Я.И., Жерносеченко А.А., Мурзич А.Э., Алейникова О.В.
Рубрики: 62.33.31, 76.29.41
Республиканский научно-практический центр детской онкологии, гематологии и иммунологии
Тема НИР: «Разработать и внедрить метод аутотрансплантации мезенхимальных стволовых клеток для регенеративного восстановления повреждения костной ткани при аваскулярном некрозе головки бедра у взрослых».
Сроки выполнения НИР: июль 2016 г. – июнь 2019 г.
Научный руководитель: д-р мед. наук, проф., чл.-кор. НАН Беларуси О.В. Алейникова.
Источник финансирования: госбюджет.
Применение мезенхимальных стволовых клеток (МСК) для репарации костной ткани обусловлено преимуществами, которыми обладает данный тип клеток: относительная доступность, высокая пролиферативная активность, легкость экспансии in vitro, конституционная предрасположенность к дифференцировке в остеогенном направлении. Известно, что МСК, полученные из костного мозга, демонстрируют выраженную способность к остеогенезу и в присутствии таких индукторов остеогенной дифференцировки, как аскорбиновая кислота, β-глицеролфосфат, гидрокортизон или дексаметазон начинают активно синтезировать щелочную фосфатазу, фосфат кальция и внеклеточный матрикс. Реконструкция обширного участка костной ткани требует тканеинженерного подхода, т. е. создания клеточной конструкции на основе носителя c сохранением жизнеспособности и функциональной активности клеток, поэтому материал, выбранный в качестве матрицы, может играть ключевую роль, так как является каркасом, на котором происходит тканеобразование.
Цель исследования - создание имплантата на основе аутологичных МСК для репарации костной ткани.
Исследование оптимальной степени дифференцировки клеток для создания имплантата проводили на МСК, полученных из образцов костного мозга здоровых доноров. Изучали эффективность использования недифференцированных МСК и МСК, стимулированных к остеогенезу in vitro при культивировании в дифференцировочной среде, содержащей 10 ммоль глицерол-2-фостата, 1 % антибиотика, 50 мкмоль L-аскорбиновой кислоты, 10 нг/мл BMP-2, 100 нмоль дексаметазона. Для выбора оптимального носителя недифференцированные и индуцированные к дифференцировке МСК заселяли в фибриновый гель, коллагеновую губку «Lyostypt» и гранулы гидроксиапатита «КоллапАн-Р» с дальнейшим культивированием клеток в составе скаффолдов в дифференцировочной среде. Морфофункциональное состояние клеток оценивали через 14 сут методом гистологического анализа каждой из 3D культур.
Результаты сравнительного исследования свойств различных носителей для получения имплантата МСК показали, что в качестве скаффолда наиболее перспективно использовать фибриновый гель, который равномерно заселялся клетками морфологически подобными остеобластам с высокой функциональной активностью. Остеогенная дифференцировка МСК в геле подтверждалась синтезом щелочной фосфатазы. Применение в качестве носителя коллагеновой гемостатической губки менее эффективно, так как на ее поверхности адсорбируется значительно меньше МСК, а в биоактивированном гидроксиапатите «Коллапан-К» клетки вовсе не были обнаружены. Большинство внесенных недифференцированных МСК через 14 сут равномерно распределялось внутри фибринового геля и представляли собой крупные округлые клетки со светлой цитоплазмой, гиперхромным округлым ядром, причем часть клеток находилась в состоянии митоза. В образцах, где гель заселяли стимулированными к остеодифференцировке МСК, выявлены отдельные дистрофичные клетки округлой формы с эксцентричным гиперхромным пикнотичным ядром, которые не формировали кластеры или скопления (рисунок А, Б). То есть использование недифференцированных МСК для заселения носителя с последующей дифференцировкой клеток в присутствии факторов, индуцирующих остеогенез, являлось более эффективным, чем колонизация скаффолда преддифференцированными МСК.
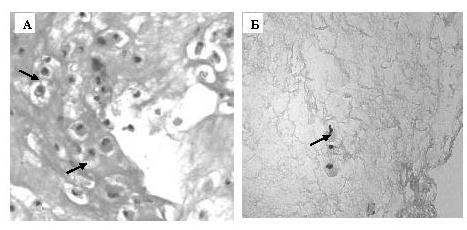
Проведено пилотное клиническое исследование совместно с сотрудниками РНПЦ травматологии и ортопедии, включавшее 8 пациентов с аваскулярным некрозом головки бедренной кости. Для каждого пациента был создан имплантат на основе аутологичных МСК в фибриновом геле. В среднем из 64,4±4,3 мл костного мозга в течение 30-38 сут получали 32,1±3,4х106 МСК. Все полученные клеточные продукты содержали не менее 96 % жизнеспособных клеток, более 95 % из которых экспрессировали маркеры МСК: CD90, CD73, CD105. После переноса клеток в фибриновый гель и остеогенной дифференцировки МСК получали биоконструкции размером 15х15х15 мм3, содержащие в среднем 30,3±3,3х106 клеток. Гистологический анализ срезов подтвердил плотное и равномерное заселение фибринового геля жизнеспособными клетками с широкой цитоплазмой и мелким эксцентричным гиперхромным ядром, причем просветление в области комплекса Гольджи свидетельствовало об их функциональной синтетической активности. Имплантаты МСК в фибриновом геле вводили в очаг некроза непосредственно после хирургической декомпрессии. Ни у одного из пациентов побочные эффекты и осложнения не наблюдались. В 7 случаях из 8 за период наблюдения до 12 мес. после имплантации МСК удалось избежать эндопротезирования тазобедренного сустава. Клинический эффект выражался в снижении выраженности болевого синдрома и расширении объема движений в оперированном суставе. Таким образом, разработан метод получения имплантатов остеогенно дифференцированных МСК в фибриновом геле с сохранением высокой жизнеспособности и функциональной активности клеток, безопасность применения которых подтверждена при лечении пациентов с аваскулярным некрозом головки бедренной кости.
Новизна. В Беларуси это новый подход к созданию имплантатов на основе МСК в фибриновом геле, которые, учитывая пролиферативный и остеогенный потенциал клеток, могут быть использованы в клеточной заместительной терапии для восстановления костной ткани.
Область применения: травматология, хирургия.
Рекомендации по использованию: разработанный метод получения имплантатов остеогенно дифференцированных МСК в фибриновом геле с сохранением высокой жизнеспособности и функциональной активности клеток позволит использовать их для лечения пациентов с костными дефектами различной этиологии.